Landkarte der Krebsgenomforschung wird neu gezeichnet
Die genetischen Ursachen von Krebs sind noch vielfältiger als bisher wissenschaftlich belegt. Zu diesem Ergebnis kommen Forschende der ETH Zürich und des Universitätsspitals Zürich. Sie haben im Rahmen einer internationalen Forschungszusammenarbeit zum bisher umfassendsten Kompendium für krebsrelevante Gen-Veränderungen beigetragen, das auf der Analyse von vollständigen Krebsgenomen basiert.
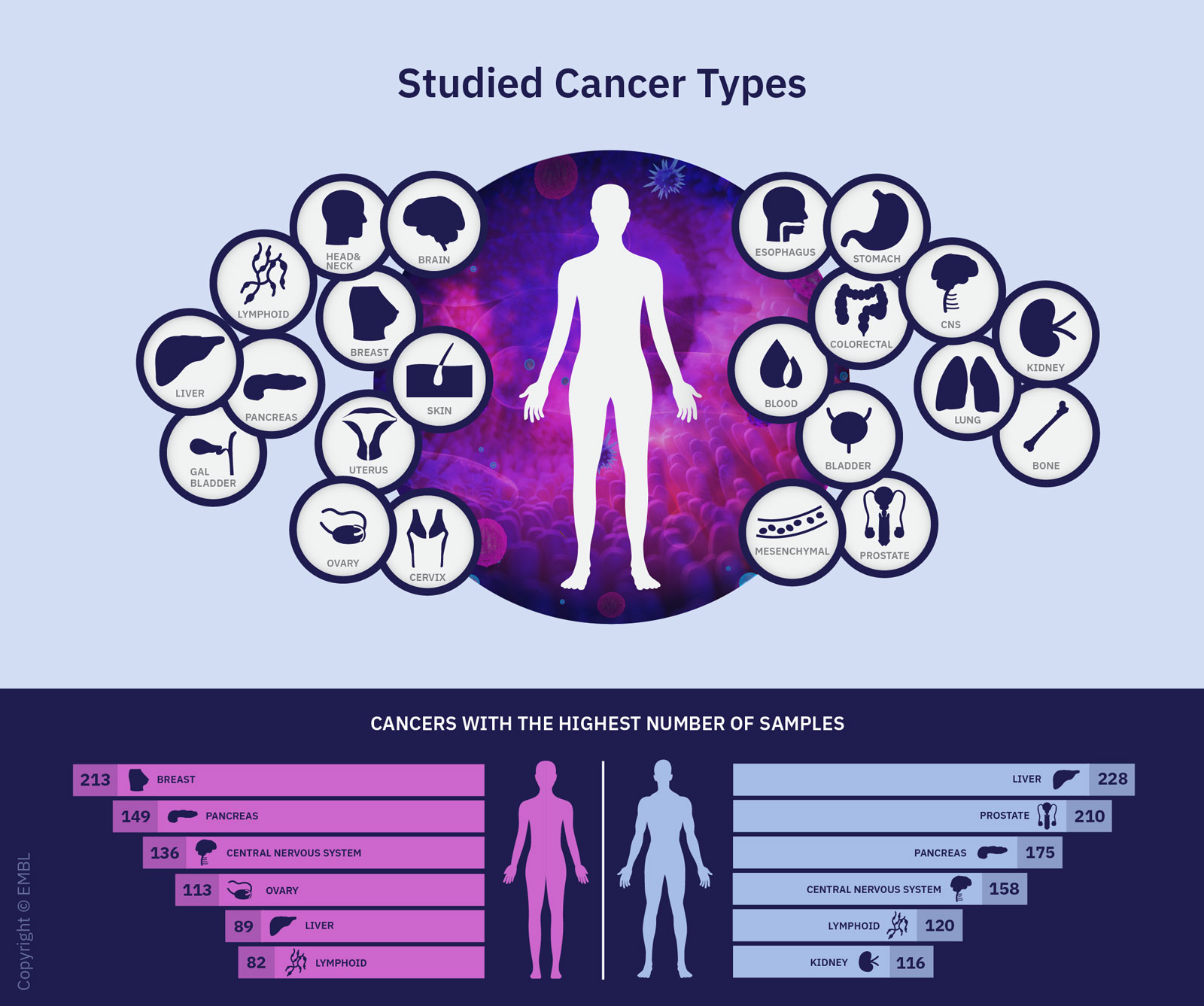
So umfassend sind die genetischen Ursachen von Krebs noch nie untersucht worden: Über 1300 Wissenschaftlerinnen und Wissenschaftler aus 37 Ländern und über 70 Forschungsinstitutionen haben sich im «Pan-Cancer Analysis of Whole Genomes Project» (PCAWG), kurz: Pan-Cancer-Projekt, zusammengeschlossen, um zu erforschen, wie genau das menschliche Erbgut Krebs verursacht.
Ihr Augenmerk richtete sich auf krebsrelevante Veränderungen im Genom. Genome sind die biologischen Speicher der gesamten vererbbaren Information einer Zelle. Im Pan-Cancer-Projekt untersuchten die Forschenden mehr als 2600 vollständige Genome von 38 verschiedene Tumorarten. Sie erfassten praktisch jedes Krebsgenom, das zu Projektbeginn zugänglich war.
Das analysierte Datenset umfasste die genomischen Daten von 2658 Spenderinnen und Spendern aus 48 Krebsforschungsprojekten. Schweizer Patientendaten wurden nicht verwendet. Um die Veränderungen in den Genomen zu verstehen, waren diese riesige Datenmenge und auch die technischen Entwicklungen nötig, um diese Daten austauschen zu können.
Ein neues Gesamtbild des Krebsgenoms
Die Ergebnisse der internationalen Forschungszusammenarbeit sind heute in 23 wissenschaftlichen Artikeln im renommierten Magazin Nature und zugehörigen Titeln erschienen. Die Forschung stehe kurz davor, sich ein vollständigeres Bild über alle an Krebs beteiligten biologischen Prozesse im Genom machen zu können, heisst es dazu in der externe Seite Medienmitteilung des PCAWG-Konsortiums.
Eine Haupterkenntnis ist, dass das Krebsgenom begrenzt und erkennbar, wenn auch enorm kompliziert sei. Tumorarten lassen sich demnach anhand von Mustern genetischer Veränderungen im Genom identifizieren.
Während frühere Studien sich auf zirka 1 Prozent des Genoms konzentrierten, wurden im Pan-Cancer-Projekt die restlichen 99 Prozent des Genoms detaillierter untersucht. Dadurch wurden neue Schlüsselregionen identifiziert, die das An- und Ausschalten von Genen regulieren und somit krebserzeugende Veränderungen auslösen können. In diesem Sinn ist die Landkarte der Krebsgenomforschung neu gezeichnet worden.
«Im Prinzip haben wir die verschiedenen Puzzleteile zu einem vollständigeren Gesamtbild zusammengesetzt. Nun können wir das Krebsgenom fast vollständig lesen», sagt Gunnar Rätsch, «auch wenn der Weg noch weit ist, bis wir alle Einzelheiten vollständig verstehen.» Im Pan-Cancer-Projekt hat der Professor für Biomedizininformatik an der ETH Zürich und am Universitätsspital Zürich eine Arbeitsgruppe geleitet – zusammen mit Angela Brooks von der University of California, Santa Cruz, und Alvis Brazma vom European Bioinformatics Institute (EMBL-EBI).
Diese Gruppe untersuchte, wie sich Veränderungen der RNS-Erbinformation auf die Entstehung von Krebs auswirken. In einer Publikation in der Fachzeitschrift Nature haben sie nun den bisher umfassendsten Katalog krebsspezifischer RNS-Veränderungen vorgestellt.
Krebsursachen auf der RNS-Ebene
Wie DNS-Veränderungen Krebs erzeugen, wurde im Pan-Cancer-Projekt prominent untersucht – sowohl DNS-Veränderungen, die vererbt werden als auch solche, die im Laufe des Lebens auftreten. In der Zelle werden die in der DNS gespeicherten Informationen in RNS übersetzt und diese wird zu weiteren Genprodukten verarbeitet. Wie nun das Autorenkollektiv um Gunnar Rätsch im grossen Umfang aufzeigt, können aber auch Veränderungen der RNS erklären, wie es zur Entwicklung von Krebs kommt.
«So ausführlich konnte man bisher noch nie nachweisen, dass RNS-Veränderungen eine so grosse Rolle bei der Entwicklung von Krebs spielen. Das ist neu», sagt Gunnar Rätsch. Es gibt Gene, wie zum Beispiel dasjenige, das im Insulin-Stoffwechsel und bei Diabetes eine wichtige Rolle spielt (IGF2), bei denen Veränderungen besonders häufig in der RNS auftreten – und zwar ohne, dass sich die DNS ebenfalls verändert. Wahrscheinlich ist ausserdem, dass DNS- und RNS-Veränderungen zusammen Krebs auslösen. Dieses Zusammenspiel ist bislang relativ wenig erforscht.
Vom Ablauf her muss man sich das so vorstellen: Die DNS ist der vererbte Teil der genetischen Information und damit die «Vorlage», nach der die RNS gebildet wird, die ihrerseits lebensnotwendige Proteine erzeugt. Wenn bei der RNS-Bildung fehlerhafte Veränderungen auftreten, kann eine solche «Alteration» Krebs auslösen. In ihrer Studie untersuchten die Forschenden Genom-Daten von 1188 Spenderinnen und Spendern, die sowohl RNS- als auch DNS-Sequenzierungsproben enthielten.
731 krebsrelevante Gene
Der Katalog für krebsverursachende Gen-Veränderungen, den die Forschenden damit erstellt haben, umfasst 27 verschiedene Tumorarten und 731 Gene, deren Veränderung krebsrelevant ist. Darunter befinden sich Gene, die sich hauptsächlich auf der DNS-Ebene verändern (wie TP53) wie auch solche, deren Veränderung am häufigsten in der RNS auftritt (wie GAS7, IGF2). 87 Tumor-Proben wiesen keine DNA-Veränderungen auf, sondern ausschliesslich RNS-Veränderungen.
Die Forschenden entdeckten 649 Fälle, in denen krebsrelevante Fehler beim Kopieren und Übersetzen der DNS in RNS auftraten, 1901 Veränderungen durch sogenanntes RNS-Spleissen und eine neue Klasse von Genfusionen (75 Fälle). Beim RNS-Spleissen werden ganze Abschnitte aus der RNS herausgeschnitten und neu zusammengesetzt. Dadurch können zuvor inaktive Gene so «eingeschaltet» werden, dass unter Umständen Krebs entsteht. Vergleichbares kann bei Genfusionen eintreten.
Insgesamt stellten die Forschenden sieben Kategorien von krebsrelevanten RNS-Veränderungen fest. «Wenn man die RNS-Veränderungen mit vererbbaren und nicht-vererbbaren Veränderungen innerhalb des Genoms in Bezug setzt, kann man weitere Gene und genetische Mechanismen erkennen, die an Krebs beteiligt sind», sagt André Kahles, der wie Natalie Davidson und Kjong Lehmann zu Rätschs Forschungsgruppe an der ETH Zürich gehört. Sie alle wirkten federführend an der Studie mit. Für die Forschung über Ursachen, Prävention, Diagnose und Behandlung von Krebs bietet dieses Kompendium der RNA-Veränderungen eine neue wertvolle Quelle.
«Leonhard Med» machte es möglich
Ein Kernfaktor zum Erfolg war die IT-Infrastruktur der ETH: Als Gunnar Rätsch und sein Team vor vier Jahren vom Memorial Sloan Kettering Cancer Center in New York an die ETH Zürich kamen, bauten sie mit den ETH-Informatikdiensten das Computersystem «Leonhard Med» auf. Der Speicher- und Rechnercluster ist extra so gebaut, dass auf ihm Muster in sehr grossen, medizinischen Datenmengen erkannt, respektive berechnet werden können. Er hat einen besonders schnell verfügbaren Speicher und erfüllte die besonderen Datenschutz- und Sicherheitsanforderungen für Medizindaten.
«Ohne ‹Leonhard Med› hätten wir uns nicht an dieser Forschungszusammenarbeit beteiligen können», sagt Rätsch, der auch dem Swiss Bioinformatics Institute angehört, das die Bioinformatik und ihre Datengrundlage in der Schweiz koordiniert.
Das Pan-Cancer-Projekt
Das «Pan-Cancer Analysis of Whole Genomes Project» (PCAWG), kurz: Pan-Cancer-Projekt) ist eine internationale Forschungszusammenarbeit, die im Rahmen des Iexterne Seite nternational Cancer Genome Consortium von fünf Institutionen geleitet wird: dem Europäischen Laboratorium für Molekularbiologie, dem Ontario Institute for Cancer Research, dem Broad Institute of MIT und Harvard, dem Wellcome Sanger Institute und der Universität von Kalifornien, Santa Cruz.
Sein Ziel ist, die genomischen Veränderungen bei vielen Krebsarten weltweit zu verstehen, um die weitere Erforschung von Ursachen, Prävention, Diagnose und Behandlung von Krebserkrankungen zu ermöglichen. Es baut auf vorhergehenden Grossprojekten wie «externe Seite The Cancer Genome Atlas» oder «externe Seite Chromothripsis Explorer» auf.
externe Seite PCAWG Portal — PanCancer Analysis of Whole Genomes.
Literaturnachweis
PCAWG Transcriptome Core Group, et al. Genomic basis for RNA alterations in cancer. Nature 2020, doi: externe Seite 10.1038/s41586-020-1970-0 .
Eine Zusammenstellung aller «PCAWG Papers» und damit zusammenhängender Inhalte findet sich beim European Molecular Biology Laboratory (EMBL) und bei Nature: