Le mitoribosome décrypté
Des chercheurs de l'ETH Zurich décryptent la structure d'une partie du ribosome des mitochondries, les centrales électriques de la cellule, avec une résolution jamais atteinte auparavant. Pour ce faire, les scientifiques ont profité des progrès de la microscopie électronique.
Les ribosomes sont des sortes d'appareils de décryptage de la cellule. Ils sont capables de décoder le code génétique qui leur est livré sous la forme d'un acide ribonucléique messager (ARN messager) et de le traduire en une séquence déterminée d'acides aminés. Enfin, l'assemblage des acides aminés en longues chaînes de protéines a également lieu dans ces complexes enzymatiques. Sans ribosomes, aucune protéine ne se forme dans une cellule. En raison de leur fonction centrale, ces complexes enzymatiques sont donc depuis longtemps au centre de l'intérêt de la biologie.
Pour mieux comprendre le fonctionnement des ribosomes, présents dans toutes les cellules, il est nécessaire de connaître précisément leur structure. Au cours des 15 dernières années, le professeur Nenad Ban de l'ETH a apporté des contributions déterminantes pour élucider la structure des ribosomes des bactéries, mais aussi des organismes supérieurs, les eucaryotes, dont font partie les champignons, les plantes et les animaux. (voir entre autres. ETH Life du 4.11.11).
L'élucidation de la structure se heurte à des obstacles
Jusqu'à présent, la structure moléculaire des ribosomes présents dans les mitochondries, les centrales électriques de la cellule, était encore largement inconnue. Ceux-ci se distinguent considérablement des ribosomes "ordinaires" du cytoplasme cellulaire. Alors que ces derniers sont composés à 60% d'acides ribonucléiques (ARN) et à 40% de composants protéiques, l'ARN ne représente qu'à peine un tiers de l'ensemble du complexe dans les ribosomes mitochondriaux. Cela s'explique notamment par le fait que ces dernières molécules d'ARN ont été fortement raccourcies au cours de l'histoire de l'évolution. Les ribosomes mitochondriaux dans la cellule sont principalement localisés sur la membrane interne des mitochondries et sont présents dans la cellule en quantité nettement plus faible que les ribosomes du cytoplasme cellulaire. C'est pourquoi ils sont plus difficiles à isoler et n'ont guère été étudiés jusqu'à présent.
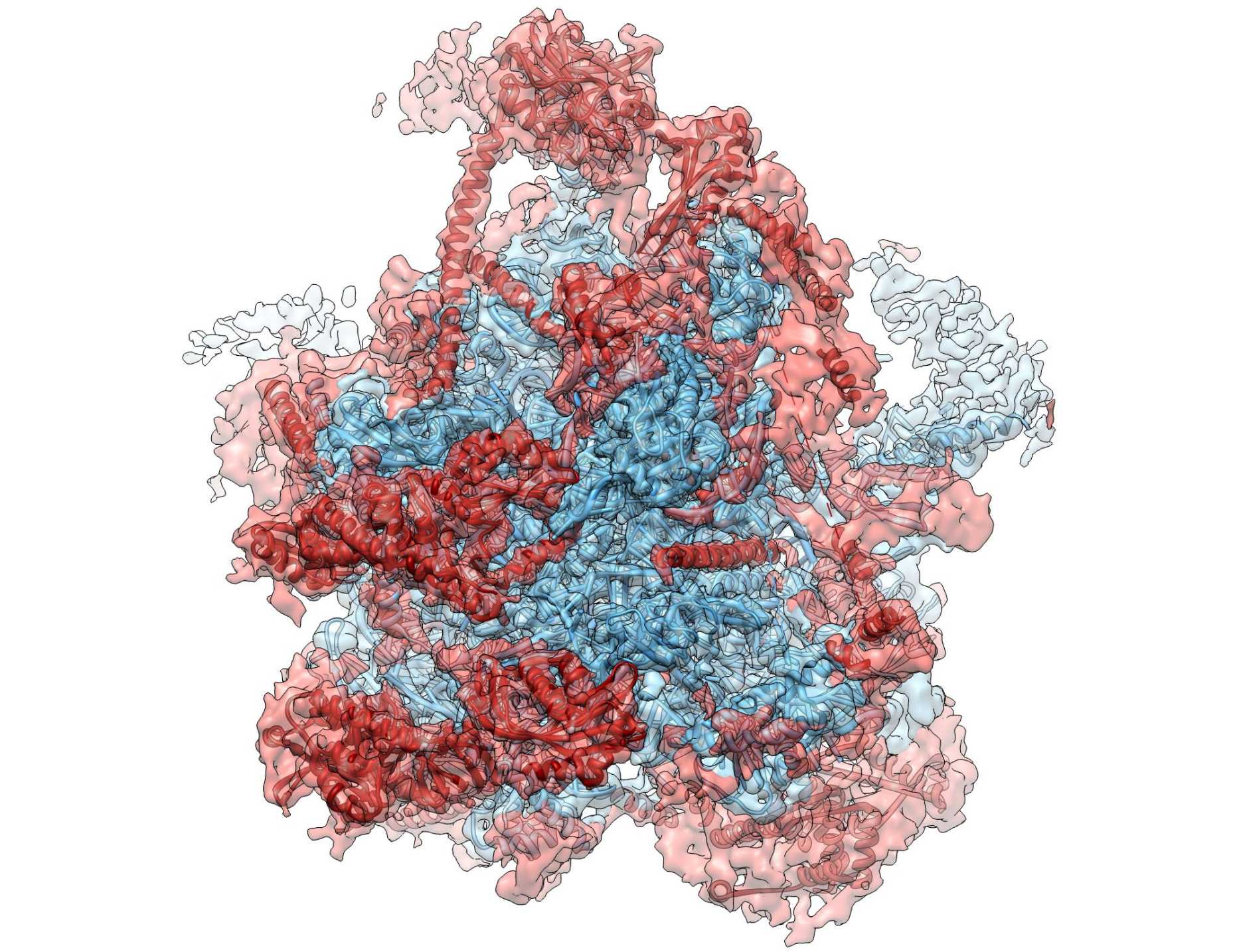
Une équipe de chercheurs des groupes de l'ETH de Nenad Ban et Ruedi Aebersold a maintenant réussi à élucider la structure moléculaire de ce qu'on appelle la grande sous-unité du ribosome mitochondrial de cellules de mammifères jusqu'à une résolution de 4,9 angströms (moins de 0,5 nanomètre). Avec une telle résolution, il est par exemple possible de voir les différents groupes de phosphates des molécules d'ARN. Les chercheurs ont publié leurs résultats en première page du dernier numéro de "Nature".
L'une des difficultés était que les ribosomes mitochondriaux ne permettent guère de former des cristaux utilisables pour la détermination de la structure. Jusqu'à présent, la cristallographie aux rayons X était utilisée pour élucider les structures des grandes molécules biologiques. Dans ce cas, la molécule est isolée, cristallisée et traversée par des rayons X. Les rayons sont déviés au niveau des atomes, ce qui crée un motif spécifique à partir duquel les positions des atomes peuvent être calculées. Pour cela, le cristal doit toutefois être suffisamment grand et de bonne qualité. Or, la grande sous-unité du ribosome mitochondrial ne se prêtait pas à ce procédé, car sa structure est trop hétérogène et il n'a pas été possible d'obtenir suffisamment de matériau pour la formation du cristal. "Nous aurions eu besoin de centaines de kilos de foie de porc pour en isoler suffisamment de matériel ribosomique pour l'analyse structurelle cristallographique. Cela n'était pas non plus réalisable d'un point de vue logistique", explique Basil Greber, premier auteur de l'étude et post-doctorant dans le groupe de Nenad Ban.
Une combinaison habile pour réussir
Les chercheurs de l'ETH ont donc utilisé la dernière génération d'appareils pour la cryo-microscopie électronique à haute résolution, disponible depuis peu au Centre de microscopie électronique de l'ETH Zurich (EMEZ) et chez le fabricant des microscopes. Les chercheurs ont ainsi pris plus d'un million de photos de la grande sous-unité du ribosome. Sur la base de ces clichés, les chercheurs ont reconstruit la représentation tridimensionnelle de cette structure grâce à des calculs complexes sur un cluster d'ordinateurs.
Afin d'interpréter le plus précisément possible la structure ainsi calculée et de déterminer la position exacte des molécules d'ARN et de protéines au sein du complexe enzymatique, les chercheurs ont en outre eu recours à une méthode développée dans le laboratoire de Ruedi Aebersold. Celle-ci est appelée "Chemical Cross Linking Combined with Mass Spectrometry" (cf. ETH Life du 18.9.12). Les différents composants protéiques du ribosome sont réticulés chimiquement entre eux, fragmentés en peptides pour une analyse ultérieure et séquencés au spectromètre de masse. Ces données permettent finalement de déterminer la structure d'un complexe protéique comme le ribosome ou sa grande sous-unité. Cela nécessite toutefois une grande puissance de calcul, raison pour laquelle l'équipe de recherche a utilisé le grand ordinateur Brutus de l'ETH.
Grâce à la combinaison de ces méthodes, les chercheurs ont finalement réussi à établir le modèle structurel à haute résolution de la grande sous-unité du ribosome mitochondrial avec une précision inégalée.
Des clés pour la recherche sur les maladies
Grâce à leur nouvelle découverte, les chercheurs de l'ETH peuvent désormais expliquer pourquoi les ribosomes mitochondriaux sont constamment intégrés dans la membrane de la mitochondrie : A proximité de la sortie du tunnel par laquelle les protéines fraîchement synthétisées quittent le ribosome, les biologistes ont pu localiser une protéine qui ressemble aux protéines servant d'ancrage à la membrane. Ils en concluent donc qu'au cours de l'évolution, une telle protéine d'ancrage a été intégrée dans le ribosome pour le fixer à la membrane mitochondriale, de sorte que les protéines fraîchement synthétisées atteignent directement leur destination dans la membrane.
Les chercheurs espèrent en outre que leur découverte révolutionnaire leur permettra de mieux comprendre le fonctionnement et les troubles de cet organite extrêmement important pour la cellule. Des défauts dans le patrimoine génétique des composants des mitochondries entraînent par exemple des maladies musculaires ou jouent un rôle dans le cancer. En effet, les cellules cancéreuses n'ont pas seulement besoin de beaucoup de nutriments pour se développer rapidement, mais aussi de beaucoup d'énergie. Leur métabolisme énergétique se trouve donc dans un état inhabituel, auquel ceux des mitochondries contribuent probablement. Nenad Ban précise toutefois qu'aucune question liée aux applications n'est actuellement traitée. "Avec la structure de ce ribosome, nous fournissons une base importante sur laquelle d'autres chercheurs peuvent s'appuyer", dit-il. Le travail publié a été soutenu par le Pôle de recherche national (NCCR) Biologie structurelle du Fonds national suisse.
Les mitochondries - la cellule énergétique de la cellule
Les mitochondries sont apparues au début de l'évolution des êtres vivants supérieurs (eucaryotes) : Il y a plus d'un milliard d'années, des cellules hôtes ont probablement "avalé" de simples bactéries qui se sont développées au fil du temps en mitochondries à l'intérieur de leurs hôtes. Celles-ci ont donc une "vie propre" et possèdent leur propre matériel génétique ainsi que la machinerie moléculaire qui traduit le code génétique en protéines. L'énergie est transformée dans les mitochondries et stockée sous forme de composés chimiques riches en énergie, qui sont à la disposition de la cellule pour tous les processus vitaux. Mais les mitochondries ne sont pas seulement des fournisseurs d'énergie, elles jouent également un rôle important dans le "suicide cellulaire", l'apoptose, qui permet d'éliminer efficacement les cellules défectueuses dans les organismes multicellulaires.
Référence bibliographique
Greber B, et al. Architecture of the large subunit of the mammalian mitochondrial ribosome. Nature 505, 515-519 (23 janvier 2014). doi :page externe10.1038/nature12890