Le proteine camaleonte rendono visibili le singole cellule
Gli scienziati hanno scoperto un nuovo meccanismo che permette a una proteina fluorescente di cambiare colore. Ciò consente di visualizzare al microscopio le singole cellule nel loro ambiente tridimensionale negli organismi viventi.
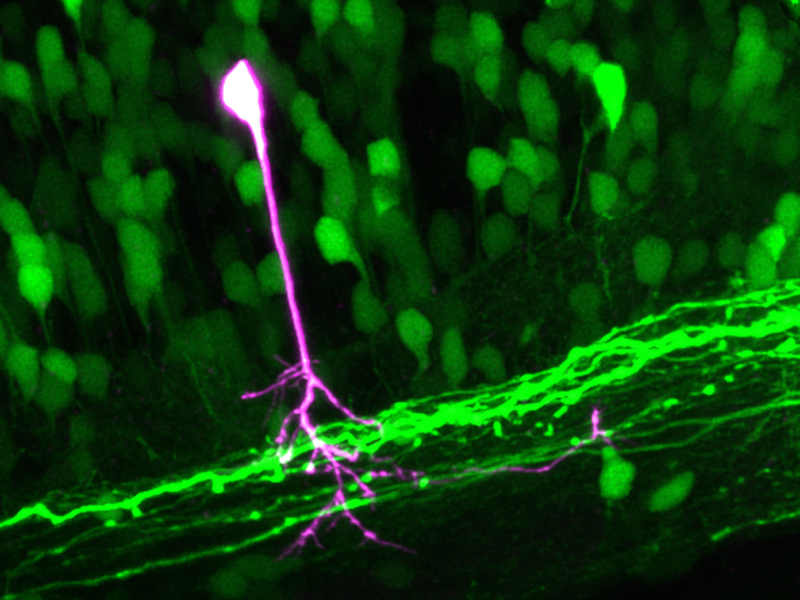
I ricercatori del Dipartimento biosistemi e ingegneria dell'ETH di Zurigo a Basilea hanno sviluppato un metodo di microscopia che consente per la prima volta di visualizzare singole cellule all'interno di una complessa struttura cellulare tridimensionale di organismi viventi. Gli scienziati hanno così potuto realizzare spettacolari immagini al microscopio del sistema nervoso di un pesce zebra vivente, il "pesce modello" della scienza. Le immagini degli scienziati dell'ETH mostrano le cellule nervose motorie nel midollo spinale del pesce zebra. Una singola cellula nervosa e tutti i suoi processi cellulari sono evidenziati in un colore diverso.
L'applicazione è iniziata con un'osservazione di William Dempsey, un postdoc del gruppo del professor Periklis Pantazis dell'ETH. Stava lavorando su una classe speciale di proteine fluorescenti (vedi riquadro). Le proteine che ha studiato sono speciali in quanto cambiano colore quando vengono irradiate con una luce laser di una certa lunghezza d'onda. Dendra 2 è una di queste "proteine camaleonte". Se gli scienziati la irradiano con luce blu, si illumina di verde. Tuttavia, se viene stimolata con un'intensa luce violetta o ultravioletta, cambia colore diventando rossa.
Combinare due laser
Cosa hanno scoperto Dempsey e Pantazis: Se Dendra 2 viene irradiata contemporaneamente con luce blu e rossa, anche la proteina cambia colore diventando rossa. Per questa combinazione di irradiazione è sufficiente una bassa intensità di luce e le cellule non vengono danneggiate, a differenza di quanto accade con l'irradiazione violetta o ultravioletta molto intensa.
Il professor Pantazis e i suoi colleghi dell'ETH hanno poi avuto un'idea di come questa combinazione di irradiazione potesse essere utilizzata nella microscopia ottica. Le proteine fluorescenti vengono utilizzate per visualizzare cellule intere, strutture cellulari precise o singole molecole. La scoperta dei Fare ricerca all'ETH rende ora possibile, per la prima volta in un organismo vivente, evidenziare a colori una cellula o una molecola nella posizione desiderata e allo stesso tempo rendere visibile l'insieme delle cellule o delle molecole con un colore diverso.
Focalizzazione su un punto
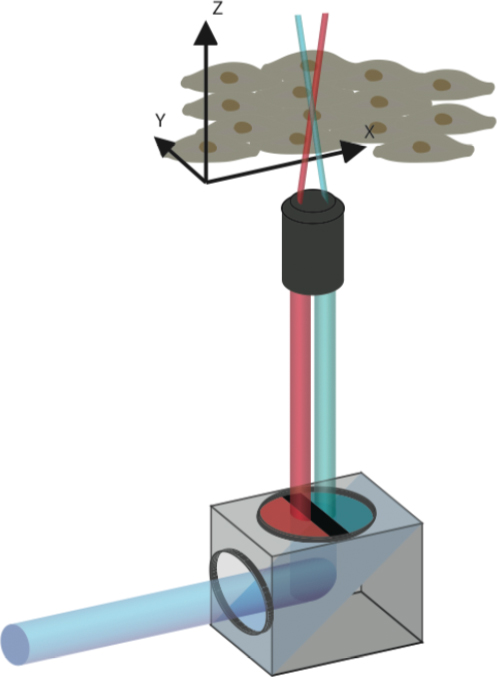
Il piano degli scienziati: due diversi raggi laser - usati singolarmente - non possono cambiare il colore di una proteina camaleontica. Tuttavia, se i due fasci vengono combinati e disposti in modo da incontrarsi in un punto specifico dell'oggetto in esame, le proteine che vi si trovano cambiano colore. Le proteine che non vengono attivate contemporaneamente con entrambi i laser, invece, mantengono il loro colore originale.
A questo scopo i ricercatori hanno sviluppato un filtro colorato semplice e poco costoso. Può essere utilizzato con i microscopi laser confocali convenzionali, disponibili in molte strutture di ricerca biomedica. Montato tra la sorgente laser e l'oggetto in esame, il filtro divide la luce laser in fasci parziali blu e rossi, che si concentrano su un piccolo punto focale nell'oggetto in esame.
Indagine sui processi in movimento
Nel caso del pesce zebra, che è trasparente e quindi particolarmente adatto alla microscopia, gli scienziati dell'ETH hanno etichettato le sue cellule nervose con il Dendra 2. Hanno poi diretto il punto focale del raggio laser combinato sul corpo cellulare di una singola cellula nervosa del pesce zebra vivo e anestetizzato. Le molecole di Dendra 2 sono diventate rosse, si sono diffuse nell'intera cellula e hanno colorato anche i processi di questa cellula. Tutte le altre cellule, soprattutto quelle nelle immediate vicinanze, sono rimaste verdi.
La possibilità di visualizzare le singole cellule nervose è di grande importanza per la mappatura precisa del cervello, ad esempio, spiega Pantazis. Poiché la nuova tecnologia è adatta alle singole cellule degli organismi viventi, può essere utilizzata anche per analizzare processi dinamici, ad esempio l'influenza di agenti farmaceutici su cellule o molecole. Può anche essere utilizzata per analizzare lo sviluppo embrionale in modo più dettagliato. "Il nostro metodo consente di effettuare analisi tridimensionali in modo elegante", afferma l'ETH. "Pantazis spera che la tecnica possa essere ampiamente utilizzata in futuro nella ricerca biomedica. A tal fine, sta dialogando con i produttori di microscopi.
Proteine fluorescenti
Le proteine fluorescenti sono diventate parte integrante della ricerca biomedica: ogni volta che uno scienziato vuole visualizzare una struttura cellulare o una determinata molecola al microscopio, colora la struttura cellulare o la molecola in modo specifico con una proteina di questo tipo. In natura, queste proteine si trovano in alcune meduse e coralli. I ricercatori hanno ora creato un'intera gamma di colori di proteine fluorescenti sintetiche. Queste si illuminano di verde, arancione, blu, rosso o giallo. In questo modo è possibile visualizzare contemporaneamente diverse strutture cellulari. Esistono anche proteine che si illuminano solo quando sono illuminate da una luce di una specifica lunghezza d'onda. Altre cambiano colore quando vengono irradiate con una luce specifica.
Letteratura di riferimento
Dempsey WP, Georgieva L, Helbling PM, Sonay AY, Truong TV, Haffner M, Pantazis P: In vivo single cell labelling by confined primed conversion, Nature Methods, 18 maggio 2015, doi: pagina esterna10.1038/nmeth.3405