Chimica per l'economia del metanolo
Poiché il prezzo del petrolio greggio è instabile e le sue risorse sono limitate, i prodotti petrolchimici vengono sempre più spesso prodotti a partire dal metanolo, soprattutto in Cina. I chimici dell'ETH di Zurigo hanno ora decifrato le prime fasi di questo processo di conversione.
È la sostanza chimica di base più prodotta al mondo: l'etene, una piccola molecola composta da due atomi di carbonio e quattro atomi di idrogeno. È un elemento di base per un'ampia gamma di polimeri e plastificanti. Il polietilene (PE), la plastica da imballaggio ampiamente utilizzata, è solo uno di questi. Sebbene l'etilene sia oggi prodotto principalmente dal cracking del petrolio greggio, i prezzi costantemente fluttuanti e le riserve limitate di petrolio greggio fanno sì che un metodo di produzione alternativo stia diventando sempre più importante: la sintesi dal metanolo. Questa fase di sintesi è nota come "metanolo-olefine" (MTO). Gli scienziati dell'ETH di Zurigo e dell'ENS di Lione hanno ora spiegato in dettaglio come avviene questa reazione.
I chimici hanno sviluppato il processo MTO alla fine degli anni '70 e oggi esistono impianti di produzione in tutto il mondo. In nessun luogo, tuttavia, ve ne sono tanti come in Cina: cinque impianti su larga scala sono in funzione e altri tredici sono in fase di progettazione. Questo perché la Cina ha un'enorme domanda di prodotti petrolchimici, ma non di petrolio grezzo. Tuttavia, il Paese ha riserve di carbone e il metanolo può essere facilmente prodotto dalla gassificazione del carbone. Il metanolo può essere prodotto anche dal gas naturale. Gli investitori cinesi stanno quindi progettando di produrre metanolo negli Stati Uniti dall'abbondante gas di scisto disponibile in quel Paese per esportarlo in Cina.
Da dove viene lo ione carbenium necessario?
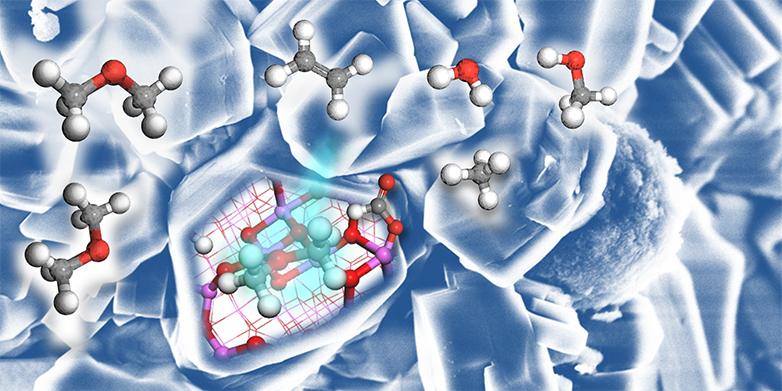
Affinché la reazione MTO possa avvenire, le cosiddette zeoliti vengono aggiunte al metanolo a 400 gradi Celsius come catalizzatore. Si tratta di grani porosi di silicato di alluminio. Per molto tempo gli scienziati non sono riusciti a spiegare con precisione il meccanismo chimico della reazione MTO. 20 anni fa, i chimici hanno ipotizzato che dovesse essere coinvolta un'altra molecola: molecole di idrocarburi a forma di anello, con carica positiva, in cui sono legati tra loro cinque o sei atomi di carbonio. Sono queste molecole, chiamate ioni carbenium, che reagiscono effettivamente con il metanolo: uniscono due molecole di metanolo e creano un legame chimico tra due atomi di carbonio, producendo etene.
Ma come fanno questi ioni carbenio a entrare nella miscela di reazione? Gli scienziati hanno ipotizzato fin dall'inizio che il metanolo potesse esserne contaminato e che questa contaminazione fosse un prerequisito per l'avvio della reazione.
Il team di ricerca svizzero-francese propone ora una spiegazione diversa. "Siamo riusciti a dimostrare che l'ossido di alluminio, presente anche nei catalizzatori di zeolite, può convertire il metanolo in l'ETH e altri idrocarburi. Questi ultimi, a loro volta, possono essere convertiti in ioni di carbenium nei pori delle zeoliti", spiega Christophe Copéret, professore di Chimica delle superfici e delle interfacce all'ETH di Zurigo e uno degli autori dello studio. "Mentre la reazione MTO funziona già molto bene su scala industriale, ora spieghiamo come avviene. Il nostro lavoro dimostra anche che semplici ossidi come l'ossido di alluminio possono innescare l'unione di due atomi di carbonio. Questo apre nuove possibilità per la conversione dei derivati del metanolo in idrocarburi a catena più lunga".
Letteratura di riferimento
Comas-Vives A, Valla M, Copéret C, Sautet P: La cooperatività tra i siti di Al promuove il trasferimento di idrogeno e la formazione di legami carbonio-carbonio all'attivazione dell'ETH sull'allumina. ACS Central Science, 5 agosto 2015, doi: pagina esterna10.1021/acscentsci.5b00226