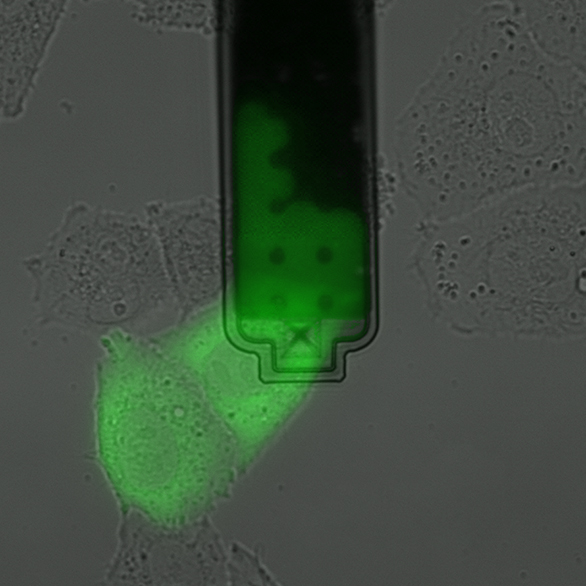
Piquer des cellules vivantes individuelles
Les biologistes s'intéressent de plus en plus au comportement de cellules individuelles plutôt qu'à celui de groupes entiers de cellules. Une nouvelle méthode pourrait révolutionner ces "analyses de cellules individuelles". Cette technique utilise la plus petite seringue du monde pour aspirer et analyser le contenu de cellules individuelles.
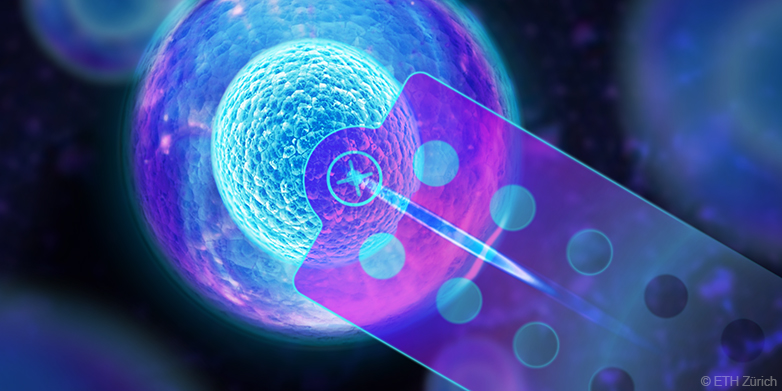
Des chercheurs de l'ETH Zurich ont développé une méthode permettant de piquer des cellules vivantes individuelles avec une micro-aiguille d'injection et d'en aspirer le contenu. Cette technique peut être utilisée par exemple sur des cultures cellulaires pour examiner l'intérieur des cellules. Elle permet d'identifier les différences entre les cellules au niveau moléculaire et donc de trouver et d'analyser des types de cellules rares. "Notre méthode élargit énormément le répertoire de la recherche biologique. Nous ouvrons pour ainsi dire un nouveau chapitre", explique Julia Vorholt, professeure au Département de biologie.
Ainsi, la méthode présente de nombreux avantages : Elle permet d'échantillonner des cellules individuelles d'une culture de tissus directement dans la boîte de culture cellulaire. "Nous pouvons ainsi étudier la manière dont une cellule du groupe cellulaire influence ses voisines", explique Orane Guillaume-Gentil, postdoctorante dans le groupe de Vorholt. De telles études ne seraient pas possibles avec les méthodes standard actuelles, car pour les analyses moléculaires, les cellules d'un groupe sont généralement séparées les unes des autres, mises en solution et détruites.
Les cellules échantillonnées restent en vie
En outre, la micro-aiguille peut être contrôlée avec une telle précision que les scientifiques peuvent puiser de manière ciblée soit dans le contenu du noyau cellulaire, soit dans le liquide qui l'entoure, le cytosol. Enfin, les chercheurs peuvent déterminer avec une extrême précision la quantité de contenu cellulaire qu'ils aspirent - à un dixième de picolitre près (à un dix milliardième de millilitre). A titre de comparaison, le volume d'une cellule est dix à cent fois plus grand.
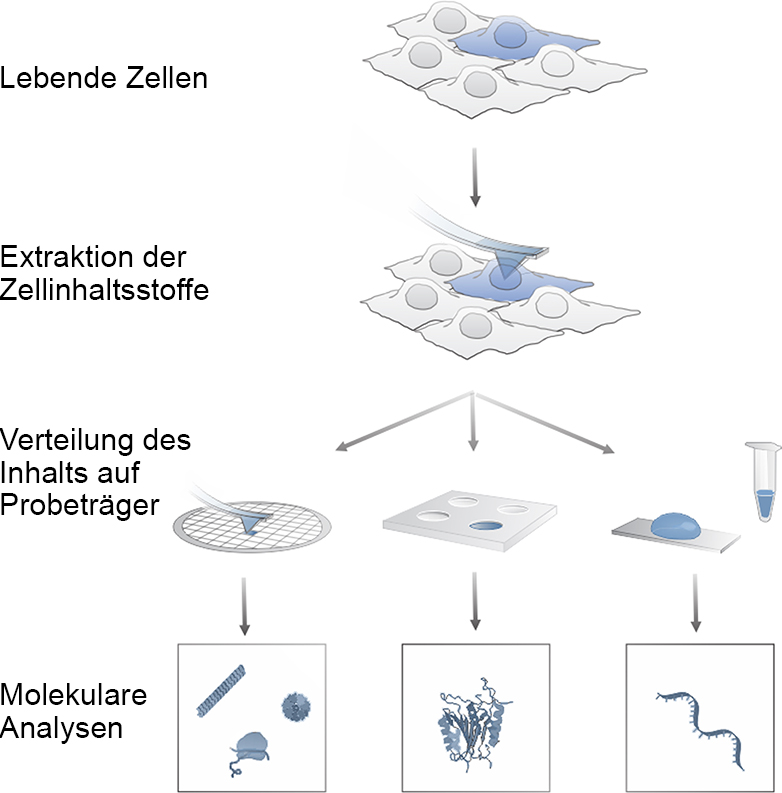
Les cellules aspirées par la micro-aiguille restent vivantes. Cela permet aux chercheurs d'échantillonner plusieurs fois la même cellule et d'analyser son ARN et ses protéines - et peut-être aussi, à l'avenir, ses métabolites. "Le fait que les cellules que nous avons étudiées aient survécu même lorsque nous avons extrait une grande partie de leur cytosol avec l'aiguille nous a surpris", explique la professeure de l'ETH Vorholt. Cela confirme toutefois l'étonnante capacité d'adaptation des cellules biologiques.
Des applications élargies
La nouvelle méthode d'extraction cellulaire se base sur le système de micro-injection FluidFM, développé ces dernières années à l'ETH Zurich et considéré comme "la plus petite aiguille d'injection du monde". Les biologistes pouvaient déjà l'utiliser pour injecter des substances dans des cellules individuelles. FluidFM et sa micro-aiguille ont également permis de soulever en douceur des cellules par dépression et de les déplacer.
Afin de pouvoir désormais extraire des substances des cellules, Vorholt et son groupe ont poursuivi le développement du système. "Il était particulièrement important de trouver un revêtement approprié pour l'aiguille, afin qu'aucune substance cellulaire ne s'y dépose", explique Guillaume-Gentil. En outre, il a fallu adapter les techniques d'analyse des substances cellulaires - par exemple celles permettant de mesurer l'activité des enzymes - aux minuscules volumes de mesure. Le développement du système s'est fait en étroite collaboration avec des chercheurs autour de Tomaso Zambelli, privat-docent au Département de technologie de l'information et de l'électrotechnique de l'ETH Zurich, avec Martin Pilhofer, professeur à l'Institut de biologie moléculaire et de biophysique, ainsi qu'avec le spin-off de l'ETH Cytosurge, qui commercialise la technique FluidFM.
Référence bibliographique
Guillaume-Gentil O, Grindberg RV, Kooger R, Dorwling-Cater L, Martinez V, Ossola D, Pilhofer M, Zambelli T, Vorholt JA : Tunable single-cell extraction for molecular analysis. Cell 2016, 166 : 506-516, doi : page externe10.1016/j.cell.2016.06.025