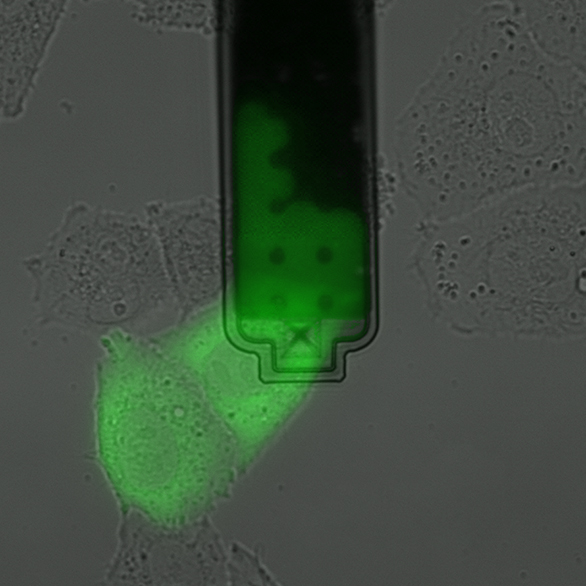
Attingere alle singole cellule viventi
I biologi sono sempre più interessati al comportamento di singole cellule piuttosto che di interi gruppi cellulari. Un nuovo metodo potrebbe rivoluzionare queste "analisi su singola cellula". La tecnica utilizza la siringa più piccola del mondo per estrarre e analizzare il contenuto di singole cellule.
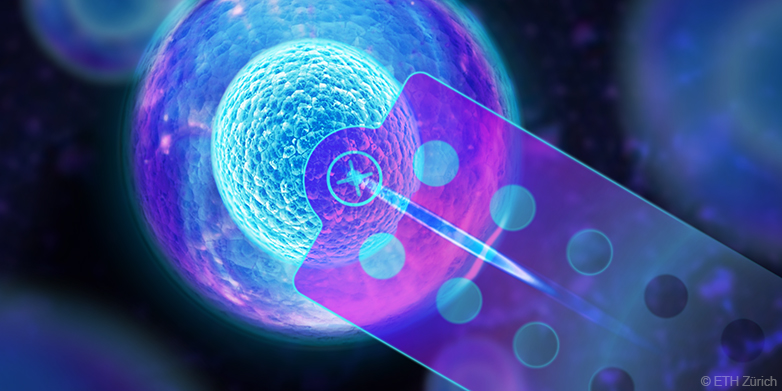
I ricercatori dell'ETH di Zurigo hanno sviluppato un metodo per pungere singole cellule viventi con un ago da microiniezione e aspirarne il contenuto. La tecnica può essere applicata alle colture cellulari, ad esempio per analizzare l'interno delle cellule. Permette di identificare le differenze tra le singole cellule a livello molecolare e quindi anche di trovare e analizzare tipi di cellule rare. "Il nostro metodo amplia enormemente il repertorio della ricerca biologica. Stiamo aprendo un nuovo capitolo, per così dire", afferma Julia Vorholt, professoressa del Dipartimento di biologia.
Il metodo presenta numerosi vantaggi: Permette di campionare le singole cellule di una coltura tissutale direttamente nel piatto di coltura cellulare. "Questo ci permette di studiare come una cellula di un cluster cellulare influenzi le cellule vicine", spiega Orane Guillaume-Gentil, postdoc nel gruppo di Vorholt. Tali indagini non sarebbero possibili con i precedenti metodi standard, poiché le cellule di un cluster vengono solitamente separate, disciolte e distrutte per le analisi molecolari.
Le cellule campionate rimangono vive
Inoltre, il microneedro può essere controllato in modo così preciso che gli scienziati possono prelevare in modo specifico il contenuto del nucleo cellulare o il fluido che lo circonda, il citosol. Infine, i ricercatori possono determinare con estrema precisione la quantità di contenuto cellulare che stanno aspirando, fino a un decimo di picolitro (un decimiliardesimo di millilitro). In confronto, il volume di una cellula è da dieci a cento volte più grande.
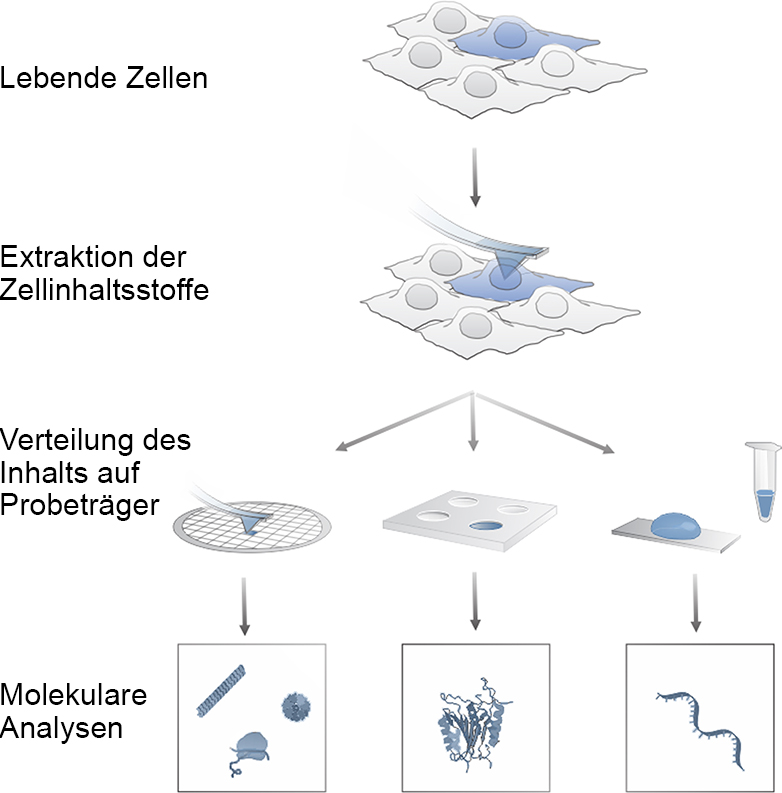
Le cellule toccate con il microago rimangono vive. Ciò consente ai ricercatori di campionare più volte la stessa cellula e di analizzarne l'RNA e le proteine - e possibilmente anche i prodotti metabolici in futuro. "Siamo rimasti sorpresi dal fatto che le cellule analizzate siano sopravvissute anche quando abbiamo estratto la maggior parte del loro citosol con l'ago", afferma l'ETH Professor Vorholt. Tuttavia, questo sottolinea l'incredibile capacità di adattamento delle cellule biologiche".
Applicazioni ampliate
Il nuovo metodo di estrazione delle cellule si basa sul sistema di microiniezione FluidFM sviluppato negli ultimi anni all'ETH di Zurigo, considerato "l'ago da iniezione più piccolo del mondo". I biologi hanno già potuto utilizzarlo per iniettare sostanze in singole cellule. FluidFM e il suo microago sono adatti anche per sollevare delicatamente le cellule con una pressione negativa e riposizionarle.
Per poter estrarre sostanze dalle cellule, Vorholt e il suo gruppo hanno ulteriormente sviluppato il sistema. "È stato particolarmente importante trovare un rivestimento adatto per l'ago, in modo che non vi si depositasse il contenuto delle cellule", afferma Guillaume-Gentil. È stato inoltre necessario adattare le tecniche di analisi del contenuto cellulare, come quelle per la misurazione dell'attività degli enzimi, ai piccoli volumi di misura. Il sistema è stato ulteriormente sviluppato in stretta collaborazione con i ricercatori guidati da Tomaso Zambelli, libero docente presso il Dipartimento di ingegneria elettrotecnica e dell'informazione dell'ETH di Zurigo, con Martin Pilhofer, professore presso l'Istituto di biologia molecolare e biofisica, e con lo spin-off Cytosurge dell'ETH, che commercializza la tecnologia FluidFM.
Letteratura di riferimento
Guillaume-Gentil O, Grindberg RV, Kooger R, Dorwling-Cater L, Martinez V, Ossola D, Pilhofer M, Zambelli T, Vorholt JA: Tunable single-cell extraction for molecular analysis. Cell 2016, 166: 506-516, doi: pagina esterna10.1016/j.cell.2016.06.025