Les protéines rares s'effondrent plus tôt
Certains organismes résistent à des sources chaudes, d'autres seulement à des températures douces, car leurs protéines ne résistent pas de la même manière à la chaleur. Des chercheurs de l'ETH se sont penchés sur ces différences et ont montré que souvent, seules quelques protéines clés déterminent la vie ou la mort par la chaleur d'une cellule.

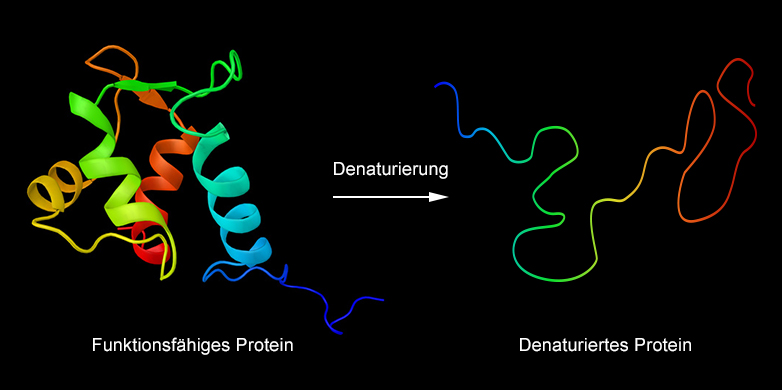
On casse un œuf, on le fait glisser dans la poêle à frire chaude - et presque immédiatement après, le blanc d'œuf transparent et gluant devient blanc et solide. Ce que l'on observe en passant en faisant frire des œufs au plat est un phénomène biochimique important : la dénaturation des protéines.
Les protéines sont produites dans la cellule sous forme de molécules filamenteuses qui sont ensuite agglomérées en une forme spécifique à la protéine : Certaines sont sphériques, d'autres tubulaires. Lors de la dénaturation, ces formes se désagrègent. Les protéines redeviennent filamenteuses et perdent ainsi également leurs fonctions.
Dénaturation d'un seul coup ?
Jusqu'à présent, la recherche partait du principe, sur la base d'analyses informatiques, qu'une grande partie des protéines d'une cellule se dénaturent lorsque l'étroite plage de température dans laquelle les protéines fonctionnent de manière optimale est dépassée. Dans le cas de la bactérie intestinale E. coli la température de fonctionnement optimale se situe autour de 37 degrés Celsius, à partir de 46 degrés, les bactéries meurent parce que les formes de leurs protéines se désintègrent.
Cette hypothèse de principe est désormais renversée par une équipe de chercheurs dirigée par Paola Picotti, professeure assistante en biochimie à l'ETH Zurich. Dans une étude qui vient de paraître dans la revue spécialisée "Science", les chercheurs démontrent que lorsqu'un seuil de température critique est atteint, seule une petite partie des protéines clés se dénaturent simultanément.
Dans leur étude - la plus complète jamais réalisée sur ce sujet - ils ont examiné et comparé l'ensemble des protéines, le protéome, de quatre organismes à différentes températures. Les chercheurs ont ainsi placé la bactérie intestinale E. coli, cellules humaines, cellules de levure et bactérie résistante à la chaleur. T. thermophilusLes cellules ont été soumises à des températures augmentant progressivement jusqu'à 76 degrés. Après chaque étape de température, les scientifiques ont mesuré toutes les protéines présentes dans les cellules et déterminé leur structure. Au total, les chercheurs ont analysé 8000 protéines différentes.
Des composants clés se désintègrent d'abord
"Grâce à ces études, nous pouvons désormais montrer qu'à des températures auxquelles les organismes meurent respectivement, seules quelques protéines s'effondrent", explique Picotti. "Nous n'avons pas pu confirmer la prédiction selon laquelle la majorité des protéines d'un organisme se dénaturent simultanément".
Environ 80 des protéines étudiées se décomposaient déjà lorsque la température dépassait de quelques degrés l'optimum spécifique à l'espèce. Bien qu'elles ne représentent qu'une petite partie des protéines d'une cellule, cela est fatal pour la cellule, car certains de ces types de protéines exercent des fonctions vitales ou sont des composants clés centraux dans un grand réseau de protéines. "Dès que ces composants clés font défaut, la cellule ne peut plus continuer à vivre", explique Picotti.
La flexibilité peut rendre instable
Le fait que les composants clés d'un système biologique soient sensibles à la chaleur apparaît au premier abord comme une erreur de l'évolution. Mais ces protéines sont instables en raison de leur flexibilité, afin de pouvoir accomplir de multiples tâches dans la cellule, explique la biochimiste. "La flexibilité et la stabilité peuvent s'exclure mutuellement. La cellule doit alors faire un compromis".
Les chercheurs montrent en outre que les protéines les plus stables et les moins susceptibles de s'agglutiner ou de se replier de manière anormale sont aussi les plus fréquentes dans les cellules. Du point de vue de la cellule, cela est logique. Si c'était le contraire et que les protéines les plus fréquentes adoptaient le plus rapidement des structures anormales, la cellule devrait investir beaucoup d'énergie pour les reconstruire ou les éliminer. C'est pourquoi les cellules veillent à ce que les protéines fréquentes soient plus stables que les protéines rares.
Mais pourquoi la bactérie ne peut-elle pas T. thermophilus même des températures de plus de 70 degrés ne les affectent pas ? Selon la chercheuse, ces cellules stabiliseraient de préférence les protéines les plus sensibles à la chaleur et indispensables à leur fonctionnement, notamment grâce à des séquences protéiques adaptées.
Des bactéries tolérantes à la chaleur pour les processus industriels
Les découvertes de Picotti pourraient aider à modifier génétiquement des organismes pour qu'ils supportent des températures plus élevées. Aujourd'hui déjà, certains produits chimiques, comme l'éthanol, sont produits par biotechnologie à l'aide de bactéries. Souvent, ces bactéries ne fonctionnent que dans une fenêtre de température étroite, ce qui limite toutefois le rendement. Si la production pouvait se dérouler à des températures plus élevées, le rendement pourrait être optimisé sans que les bactéries ne soient endommagées.
Les chercheurs ont également trouvé des signes indiquant que certaines protéines dénaturées ont tendance à s'agglutiner à nouveau et à former des agrégats à des températures encore plus élevées. Dans des cellules humaines, Picotti et ses collègues ont trouvé la protéine DNMT1 qui se dénature d'abord et s'agrège ensuite avec ses semblables lorsque la chaleur augmente. Cette protéine, ainsi que d'autres aux propriétés similaires, est associée à des maladies nerveuses telles que la maladie d'Alzheimer ou de Parkinson.
Première étude complète sur la stabilité
Cette étude est la première à examiner la stabilité à la chaleur des protéines de plusieurs organismes et à grande échelle, directement dans la matrice cellulaire complexe. Les protéines n'ont pas été isolées du jus cellulaire ni purifiées pour les mesures. Pour leurs analyses, les chercheurs ont ouvert les cellules et ont ensuite mesuré la stabilité de toutes les protéines directement dans le jus cellulaire à différentes températures.
Référence bibliographique
Leuenberger P, Ganscha S, Kahraman A, Cappelletti V, Boersema PJ, von Mering C, Claassen M, Picotti P. Cell-wide analysis of protein thermal unfolding reveals determinants of thermostability. Science 2017. 355 : eaal7825, doi : page externe10.1126/science.aal7825