Traiter l'anémie avec des ciseaux génétiques
Mandy Boontanrart, biologiste moléculaire à l'ETH, étudie des thérapies géniques qui pourraient remédier à des maladies génétiques courantes de l'anémie. Elle a maintenant développé une solution prometteuse pour les hémoglobinopathies bêta.

De nombreuses maladies héréditaires sont jusqu'à présent considérées comme incurables. L'intervention sur le patrimoine génétique est trop imprévisible et compliquée, l'issue de la modification trop incertaine. Car souvent, ce n'est pas un seul gène qui est impliqué dans l'apparition de la maladie, mais plusieurs, qui peuvent se trouver sur différents chromosomes.
Depuis que l'utilisation des ciseaux génétiques CRISPR/Cas9 s'est répandue de manière quasi explosive, les règles du jeu ont massivement changé. La modification ciblée de gènes isolés ou même d'éléments constitutifs du patrimoine génétique a ainsi fait un grand bond en avant au cours des dernières années. Grâce à cet effort commun des chercheurs du monde entier, la guérison des maladies héréditaires chez l'homme est désormais à portée de main.
Utiliser des ciseaux génétiques contre les bêta-hémoglobinopathies
La biologiste moléculaire Mandy Boontanrart, du groupe du professeur Jacob Corn de l'ETH, veut elle aussi s'attaquer à une maladie héréditaire avec la technique CRISPR/Cas9. Elle vient de collaborer à une étude qui pourrait s'avérer révolutionnaire pour le traitement des bêta-hémoglobinopathies héréditaires, deux formes d'anémie. Il s'agit notamment de la bêta-thalassémie et de la drépanocytose, deux des maladies héréditaires les plus fréquentes au monde.
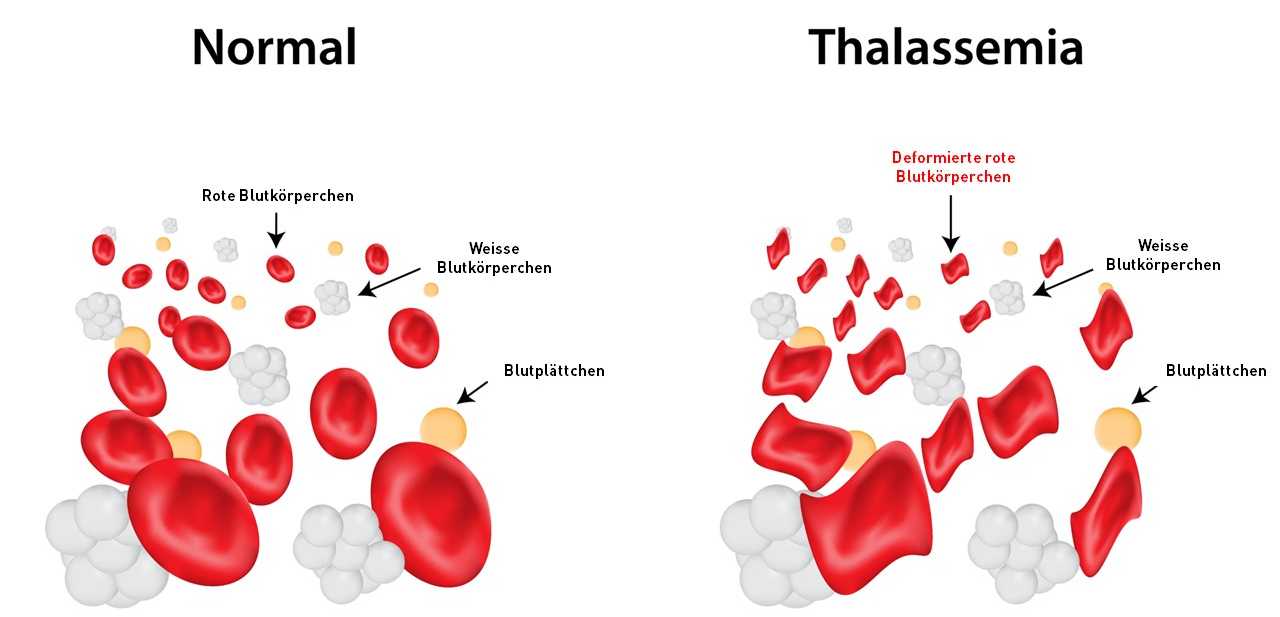
Les bêta-hémoglobinopathies sont causées par des mutations du gène HBB. Celui-ci est le plan de construction d'une chaîne de protéines appelée bêta-globine, un composant du pigment rouge du sang, l'hémoglobine, qui se trouve en millions d'exemplaires dans les globules rouges et qui est responsable du transport de l'oxygène dans le corps. Chez les adultes, l'hémoglobine est généralement composée de deux alpha-globines et de deux bêta-globines. Dans une moindre mesure, on trouve également de l'hémoglobine composée de deux alpha-globines et de deux delta-globines. Cette dernière fonctionne de la même manière que la bêta-globine, mais n'est naturellement produite qu'en très petites quantités dans les globules rouges.
Si une mutation du gène HBB entraîne une production défectueuse de bêta-globines, il en résulte un manque d'hémoglobine fonctionnelle. Typiquement, cela peut entraîner la mort prématurée des globules rouges. Il en résulte une anémie. Les organes et l'ensemble du corps sont alors chroniquement sous-alimentés en oxygène.
Si une seule copie du gène HBB est mutée, les sponsors de la mutation peuvent mener une vie plus ou moins normale. "Certes, une personne porteuse d'une mutation aura du mal à devenir une athlète professionnelle, mais on peut quand même faire du jogging, de la natation et du vélo", explique Boontanrart, elle-même porteuse d'un gène muté. Si les deux copies du gène sont endommagées, cela devient problématique : "Si l'on souhaite avoir des enfants avec un partenaire qui présente également la mutation, les enfants pourraient recevoir les deux gènes mutés, l'un du père, l'autre de la mère. Ces enfants seraient gravement malades".
Stimuler la production de delta-globine
Il n'existe toutefois pas de traitement efficace pour les bêta-hémoglobinopathies. Dans leur nouvelle étude, Boontanrart et ses collègues montrent que le problème pourrait être résolu en favorisant la formation de delta-globine, qui remplace la bêta-globine défectueuse. "L'homme ne produit naturellement que de faibles quantités de delta-globines. Cela est dû à une séquence de commande spéciale de l'ADN qui empêche la transcription du gène correspondant". Les chercheurs ont donc eu l'idée de modifier cette séquence de commande de manière à stimuler la production de delta-globine.
Pour y parvenir, Boontanrart a utilisé les ciseaux génétiques CRISPR/Cas9. Elle a ainsi inséré trois segments d'ADN supplémentaires dans des cellules précurseurs du sang avant le gène HBD, le plan de construction de la delta-globine. Ceux-ci incitent la machinerie cellulaire à produire davantage de delta-globine - ce qui a effectivement réussi.
Les résultats sont prometteurs : "Nous avons pu augmenter de manière significative la part de delta-globine, et ce à un niveau qui pourrait être efficace sur le plan thérapeutique", explique la chercheuse.
L'insertion de plusieurs éléments d'ADN reste toutefois un grand défi, selon elle. "C'est plus exigeant que la technique utilisée par d'autres groupes de recherche et entreprises pharmaceutiques", souligne Mme Boontanrart. Des chercheurs américains utilisent également le système CRISPR/Cas9 pour s'attaquer aux bêta-hémoglobinopathies en faisant en sorte que les cellules souches sanguines produisent de l'hémoglobine fœtale. Celle-ci est la forme d'hémoglobine prédominante chez les fœtus. La production s'arrête au plus tard quelques mois après la naissance. L'Hb fœtale doit remplacer la bêta-globine dans la nouvelle thérapie. Cette approche est actuellement examinée par la Federal Drug Administration (FDA) en vue de son admission.

"Augmenter la production de delta-globine, c'est à mon avis la meilleure option thérapeutique".Mandy Boontanrart
Bien qu'elle soit très avancée, cette méthode présente toutefois des inconvénients, explique Boontanrart. Elle ne peut par exemple pas être utilisée chez les femmes enceintes ou qui souhaitent le devenir, car l'hémoglobine fœtale fixe davantage l'oxygène que l'hémoglobine des adultes. La mère pourrait ainsi priver son enfant à naître d'oxygène.
"Augmenter la production de delta-globine, c'est à mon avis la meilleure option thérapeutique. L'hémoglobine delta a des propriétés très similaires à celles de la bêta-globine et peut être utilisée pour presque tous les patients", explique Boontanrart.
Le spin-off est en cours de création
Afin de transposer les résultats de ses recherches dans la pratique, Boontanrart a lancé le projet Ariya Bio en 2021, pendant son ETH Pioneer Fellowship. Il est basé dans l'ieLab de l'ETH à Schlieren, aux portes de la ville de Zurich. En 2022, l'ETH Zurich a en outre déposé une demande de brevet afin de protéger le développement.
Boontanrart est maintenant en train de préparer des études précliniques grâce à deux subventions de raccordement, à une bourse de bridge du FNS et à des fonds d'Innosuisse, le programme de promotion de l'innovation de la Confédération suisse. Ces études devraient débuter en septembre. Avec ces études, les chercheurs veulent tester pour la première fois l'approche thérapeutique sur des animaux afin de déterminer si elle est sûre et efficace dans des organismes vivants. Jusqu'à présent, les essais ont été réalisés en culture cellulaire.
La chercheuse espère que d'ici 2030, tous les tests cliniques seront terminés et qu'un produit sera disponible. "Je suis optimiste sur le fait que nous obtiendrons l'admission plus rapidement que les méthodes d'édition de gènes qui sont aujourd'hui en cours d'examen, car elles contribuent à ouvrir la voie à notre approche."
Référence bibliographique
Boontanrart MY, Mächler E, Ponta S, Nelis JC, Preiano VG, Corn JE (2023) L'ingénierie du promoteur endogène de la HBD augmente l'HbA2 eLife 12:e85258. doi : page externe10.7554/eLife.85258