Pour que les antibiotiques agissent comme ils le devraient
Des chercheurs de l'ETH Zurich ont décrypté la structure de la grande sous-unité du ribosome des mitochondries jusque dans le détail atomique. Cela permet d'avoir un aperçu sans précédent de l'architecture moléculaire de ce ribosome et du mode d'action des antibiotiques.
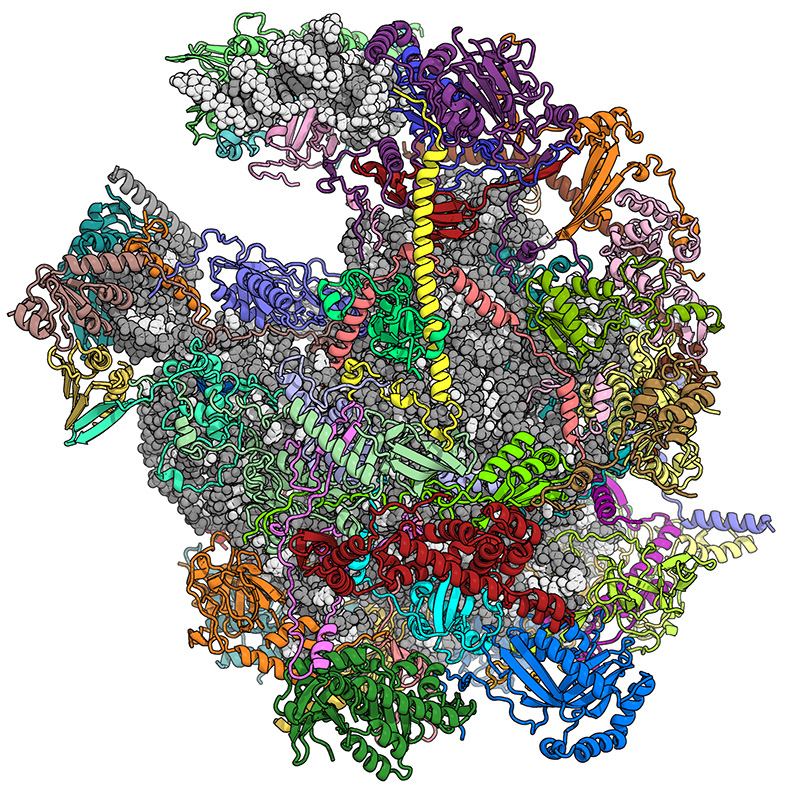
Une équipe de chercheurs de l'ETH Zurich, réunie autour des professeurs Nenad Ban et Ruedi Aebersold, a étudié la structure moléculaire très complexe des mitoribosomes, les ribosomes des mitochondries. Les ribosomes sont présents dans les cellules de tous les organismes vivants. Cependant, les organismes supérieurs (eucaryotes), dont font partie les humains en plus des champignons, des plantes et des animaux, présentent des ribosomes beaucoup plus complexes que les bactéries. Chez les eucaryotes, les ribosomes peuvent en outre être divisés en deux types : ceux du cytosol, la majeure partie de la cellule, et ceux des mitochondries, les centrales électriques des cellules. Les mitochondries ne sont présentes que chez les eucaryotes.
Les ribosomes servent d'appareil de décodage et sont étroitement impliqués dans le processus de formation des protéines. Chaque ribosome est composé de deux sous-unités. La plus petite sous-unité décode, à l'aide d'acides ribonucléiques de transfert (ARN de transfert ou ARNt), le code génétique qui lui est livré sous forme d'ARN messager. La plus grande sous-unité assemble les acides aminés fournis par l'ARN de transfert comme des perles pour former une chaîne de protéines.
Une résolution encore plus élevée, encore plus de détails
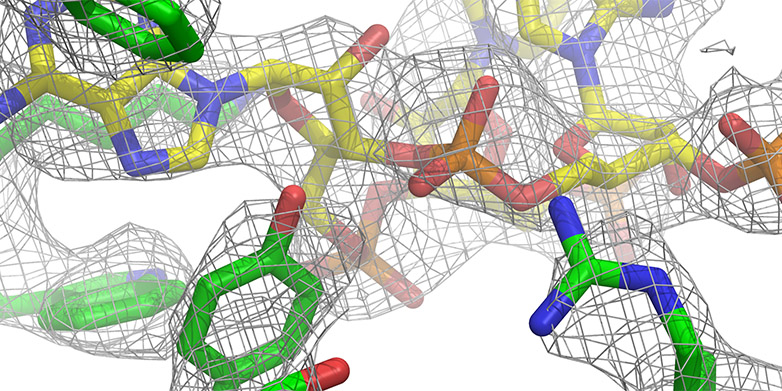
Les ribosomes mitochondriaux sont particulièrement difficiles à étudier, car ils sont peu nombreux et difficiles à isoler. Au début de l'année, les chercheurs de l'ETH avaient déjà élucidé la structure moléculaire de la grande sous-unité du mitoribosome des cellules de mammifères jusqu'à une résolution de 4,9 angströms (moins de 0,5 nanomètre). Toutefois, cette résolution n'était pas assez élevée pour construire de manière fiable un modèle atomique de la structure alors inconnue. C'est ce qu'a réussi à faire l'équipe du professeur Nenad Ban de l'ETH. Ils ont pu décrypter la structure complète à 3,4 angströms (0,34 nanomètre). Les scientifiques viennent de publier leurs résultats dans la revue spécialisée "Nature".
Les analyses ont fait appel à la cryo-microscopie électronique à haute résolution du Centre de microscopie électronique de l'ETH Zurich (ScopeM) et aux méthodes les plus modernes de spectrométrie de masse. Grâce aux récents progrès techniques en cryo-microscopie électronique et au développement de caméras à électrons capables de corriger les mouvements les plus infimes, il est possible depuis peu de photographier des biomolécules avec une résolution inférieure à quatre angströms.
Améliorer l'efficacité des antibiotiques
Les nouvelles images montrent notamment une vue détaillée du centre de la peptidyl transférase (PTC), c'est-à-dire l'endroit où les éléments constitutifs des acides aminés sont reliés. Les protéines ainsi synthétisées traversent ensuite un tunnel par lequel elles quittent finalement la grande sous-unité du ribosome.
"Ce processus a une importance médicale", explique Basil Greber, premier auteur de l'étude et post-doctorant dans le groupe de Nenad Ban. En effet, ce tunnel est utilisé comme point d'attaque pour certains antibiotiques : L'antibiotique se fixe dans le tunnel et empêche les protéines fraîchement produites de le quitter. Toutefois, les antibiotiques ne sont censés inhiber que la synthèse des protéines au niveau des ribosomes des bactéries.
"Pour qu'un antibiotique puisse être utilisé chez l'homme, il ne doit pas s'attaquer aux ribosomes humains", explique Greber. Les antibiotiques ne peuvent inhiber la synthèse des protéines que dans le cas des ribosomes bactériens. Mais le problème est que les ribosomes mitochondriaux ressemblent à ceux des bactéries. C'est pourquoi certains antibiotiques perturbent également les mitoribosomes. "Grâce aux résultats des chercheurs de l'ETH, il sera possible à l'avenir de concevoir des antibiotiques qui n'inhibent que les ribosomes bactériens et non les ribosomes mitochondriaux. Une condition sine qua non pour qu'ils puissent être utilisés en clinique.
Découverte surprenante
Les chercheurs de l'ETH ont également fait une découverte inattendue. Ils ont constaté que les mitoribosomes utilisent l'ARN de transfert de deux manières fondamentalement différentes. D'une part, ils utilisent l'ARNt pour sélectionner le bon acide aminé pour la synthèse peptidique dans le PTC. D'autre part, contrairement à tous les autres ribosomes, un ARNt est solidement intégré dans la structure. Cela permet de remplacer fonctionnellement un acide ribonucléique (ARN) qui a été perdu au cours de l'évolution. On savait certes depuis longtemps que les ribosomes mitochondriaux avaient intégré de nouvelles protéines dans leur structure au cours de leur évolution. Mais c'est la première fois que l'on observe l'utilisation d'une toute nouvelle molécule d'ARN. "Cela montre à quel point les mitoribosomes sont capables de s'adapter", souligne Greber.
Dans le cadre de ses recherches, l'équipe de l'ETH est maintenant confrontée à la grande tâche, jusqu'ici non résolue, de déterminer la structure de la sous-unité plus petite du ribosome mitochondrial. Comme celle-ci est plus flexible que la grande sous-unité, le défi est encore plus grand.
Référence bibliographique
Greber BJ, Boehringer D, Leibundgut M, Bieri P, Leitner A, Schmitz N, Aebersold R, Ban N : The complete structure of the large subunit of the mammalian mitochondrial ribosome. Nature, publication en ligne du 1er octobre 2014. doi : page externe10.1038/nature13895
Greber B et al : Architecture of the large subunit of the mammalian mitochondrial ribosome. Nature 2014, 505 : 515-519. doi : page externe10.1038/nature12890