Comment une image légendaire de pomme a stimulé l'amélioration de l'analyse cellulaire
Identifier un petit nombre de cellules pathogènes parmi plusieurs millions est une tâche délicate. Des chercheurs de l'ETH Zurich ont désormais perfectionné une technologie capable de saisir individuellement et dans le détail d'énormes quantités de propriétés cellulaires à petite échelle.
Tous les processus vitaux des hommes, des animaux et des plantes dépendent des activités cellulaires. Le corps humain à lui seul comprend plus de 210 types de cellules aux propriétés et fonctions spécifiques qui influencent son développement et sa santé. Connaître précisément chacune de ces cellules et leurs propriétés est une base importante pour la biologie et la médecine. Extraire l'information cellulaire recherchée est parfois un défi colossal - surtout lorsque sur un million de cellules, à peine une douzaine possède la propriété qui déclenche une maladie.
La cytométrie de flux est un procédé éprouvé qui permet à la chimie, à la biologie ou à la médecine de déterminer rapidement et en grand nombre les propriétés de cellules individuelles. Cette technologie de mesure cellulaire permet par exemple de déterminer les cellules cancéreuses ou les cellules T, ces globules blancs qui jouent un rôle important dans les défenses immunitaires.
La technologie a été inventée en 1968. Les cytomètres de flux traditionnels mesurent généralement la lumière diffusée et la fluorescence lorsque les cellules traversent un faisceau laser. Les signaux qui en résultent diffèrent en fonction de la taille, de la forme, de la structure ou de la coloration des cellules. Les cellules T, par exemple, sont très lisses et diffusent moins de lumière que les autres.
Bien combiné
Le groupe de recherche d'Andrew deMello, professeur de génie biochimique à l'ETH, est désormais parvenu à faire évoluer de manière décisive la cytométrie en flux. Leur plate-forme de cytométrie assistée par imagerie mesure les cellules et leurs propriétés plus rapidement, en plus grande quantité et avec beaucoup plus de précision que les cytomètres en flux actuels. Les chercheurs de l'ETH viennent d'exposer le fonctionnement de cette méthode dans la revue scientifique "Chem".
Les chercheurs n'ont pas réinventé l'approche. Ils ont plutôt combiné habilement des technologies existantes : Leur cytomètre en flux associe les possibilités de la microfluidique, qui étudie le comportement de petites quantités de liquides dans un espace restreint, à des méthodes de détection optique très sensibles et à l'imagerie ultrarapide.
Ils atteignent ainsi un ultra haut débit de plus de 50'000 cellules par seconde. Les cytomètres en flux basés sur la fluorescence disponibles sur le marché mesurent de manière fiable entre 100 et 20'000 cellules par seconde ; les cytomètres en flux microfluidiques ne mesurent même que jusqu'à 4000 cellules par seconde. Dans la pratique, on mesure toutefois généralement beaucoup moins de cellules, car celles-ci s'agglutinent sinon.

"Nous développons des technologies pour que les chimistes, les biologistes et les médecins puissent mener de nouvelles recherches", explique deMello. Il espère que sa plate-forme sera également plus simple et beaucoup moins chère à l'avenir que les appareils actuels.
En principe, son cytomètre à flux laminaire se compose de trois parties : au début, les cellules sont alignées étroitement les unes derrière les autres. Un flux de microliquides les conduit ensuite à travers un microcanal sinueux (voir le dessin ci-dessus) et dans la zone de détection. Là, une caméra haute résolution enregistre leur taille, leur forme et leur structure grâce aux effets de la lumière. Enfin, elles peuvent être triées en fonction de leurs caractéristiques.
Instantanés sur boucles
L'un des points forts de cette approche est que les cellules passent par plusieurs boucles parallèles. La caméra peut ainsi enregistrer avec précision un grand nombre de cellules. Cela accélère le procédé de deMello et permet de l'exécuter à des débits exceptionnellement élevés. "La combinaison de la microfluidique et de l'imagerie permet d'enrichir l'information", explique-t-il. Dans les approches traditionnelles, en revanche, un détecteur enregistre une cellule à la fois en un point donné.
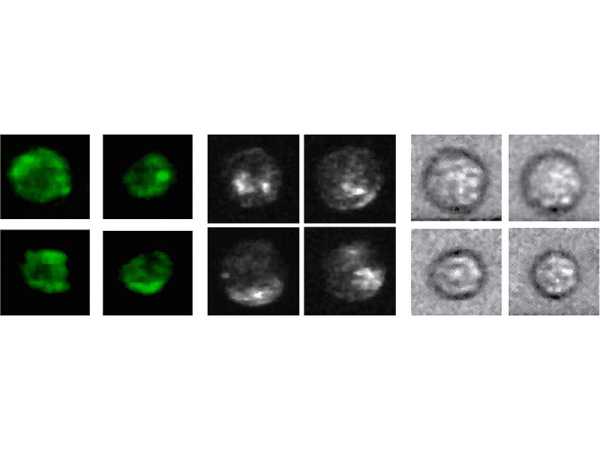
Sa technologie permet d'obtenir trois types d'images : Des images en fond noir contenant des informations sur la forme et la structure d'une cellule (ces images montrent des structures colorées sur un fond sombre), des images en fond clair contenant des informations sur la taille des cellules et des images en couleur lumineuse contenant des informations sur l'apparence et la structure interne d'une cellule. C'est surtout l'obtention d'informations morphologiques qui distingue l'approche de deMello des autres approches basées sur la fluorescence ou les microfluides.
Imagerie comme "Papa Flash
Pour un problème, le groupe de deMello a bénéficié de sa longue expérience dans la microfluidique à base de gouttelettes et dans les méthodes optiques : lorsque des gouttelettes, des cellules ou des particules minuscules s'écoulent très rapidement, les images prises sont parfois déformées et floues - comme pour les photographies.
Le groupe de recherche a trouvé la solution à ce problème dans l'histoire : pour exposer les cellules, ils ont recours à l'exposition stroboscopique, qui décompose le flux continu des cellules - comme un ralenti - en une succession d'images fixes. Cette méthode est devenue mondialement connue grâce à l'inventeur du flash stroboscopique, Harold E. Edgerton, également appelé "Papa Flash". Ses photos cultes des années 1960 ont fait le tour du monde.
Grâce à l'exposition stroboscopique, il est possible de prendre des photos nettes de cellules individuelles se déplaçant à un demi-mètre par seconde et en grande quantité.
Afin de tester la performance de leur méthode, le collaborateur deMello Stavros Stavrakis et deux étudiants ont examiné une grande population de cellules et distingué les cellules vivantes, mourantes et mortes en fonction de leur fluorescence. Dans une prochaine étape, les chercheurs de l'ETH souhaitent développer la méthode en vue d'applications bactériennes, nanoscientifiques et industrielles.
Référence bibliographique
Rane A S, Rutkauskaite J, deMello A, Stavrakis S. High-Throughput Multi-parametric Imaging Flow Ctyometry. Chem (2017), publié en ligne le 12 octobre 2017. doi : page externedx.doi.org/10.1016/j.chempr.2017.08.005
Galerie d'images
 Un ballon de basket rebondissant observé sous une lumière stroboscopique. (Photo : Michael Maggs, Richard Bartz/Wikipedia)
Un ballon de basket rebondissant observé sous une lumière stroboscopique. (Photo : Michael Maggs, Richard Bartz/Wikipedia)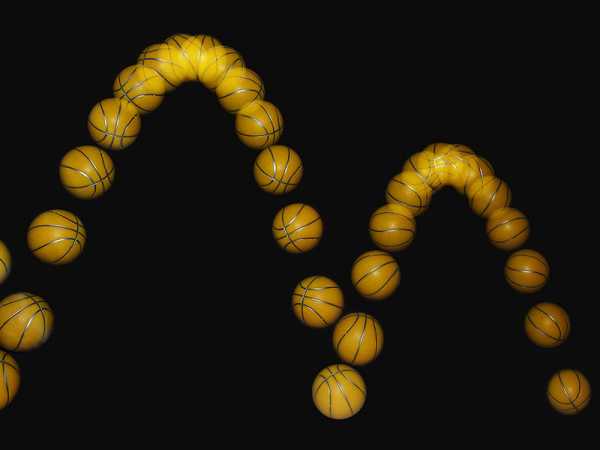 Pour la mesure, les cellules sont photographiées à la lumière flash. (Photo : Florian Meyer / ETH Zurich)
Pour la mesure, les cellules sont photographiées à la lumière flash. (Photo : Florian Meyer / ETH Zurich) La plateforme de cytométrie assistée par imagerie du groupe deMello mesure les cellules plus rapidement et plus précisément. (Image : Florian Meyer / ETH Zurich)
La plateforme de cytométrie assistée par imagerie du groupe deMello mesure les cellules plus rapidement et plus précisément. (Image : Florian Meyer / ETH Zurich) Trois types d'images peuvent être obtenus avec la technologie de deMello : Images en fond noir, images en fond clair et images en couleurs lumineuses (Image : deMello Group)
Trois types d'images peuvent être obtenus avec la technologie de deMello : Images en fond noir, images en fond clair et images en couleurs lumineuses (Image : deMello Group)