Wie Proteine in eine Zellmembran eingelagert werden
Viele Proteine mit wichtigen biologischen Funktionen sind in den Zellen von Menschen und anderen Lebewesen in eine Biomembran eingebettet. Wie kommen sie da überhaupt rein? Forschende am Departement für Biosysteme der ETH Zürich haben dies untersucht.
Fast ein Drittel aller Proteine von Lebewesen stecken in einer Biomembran fest – entweder in der Aussenmembran einer Zelle oder in den Abgrenzungen zellinterner Kompartimente. Dort übernehmen diese Membranproteine wichtige Aufgaben, beispielsweise als molekulare Schleusen, welche Stoffwechselprodukte und Nährstoffe durch die Membran transportieren, oder als Sensorproteine, um die Zellumgebung zu erfassen.
Wie Membranproteine überhaupt in die Membranen reinkommen, haben Forschende unter der Leitung von Daniel J. Müller, Professor am Departement für Biosysteme der ETH Zürich in Basel, nun untersucht. Sie nutzten dazu eine hochpräzise Methode, mit denen sie einzelne Proteine aus Membranen herausziehen beziehungsweise auf Membranen deponieren können. Einzelmolekül-Kraftspektroskopie nennt sich die Methode, bei der eine computergesteuerte und nur wenige Nanometer dicke Blattfeder präzise an einen Ort auf einer Membranoberfläche gelenkt werden kann. Molekulare Adhäsionskräfte sorgen dafür, dass sich ein dort befindendes Protein an die Blattfeder haftet.
Rolle zweier Helferproteine
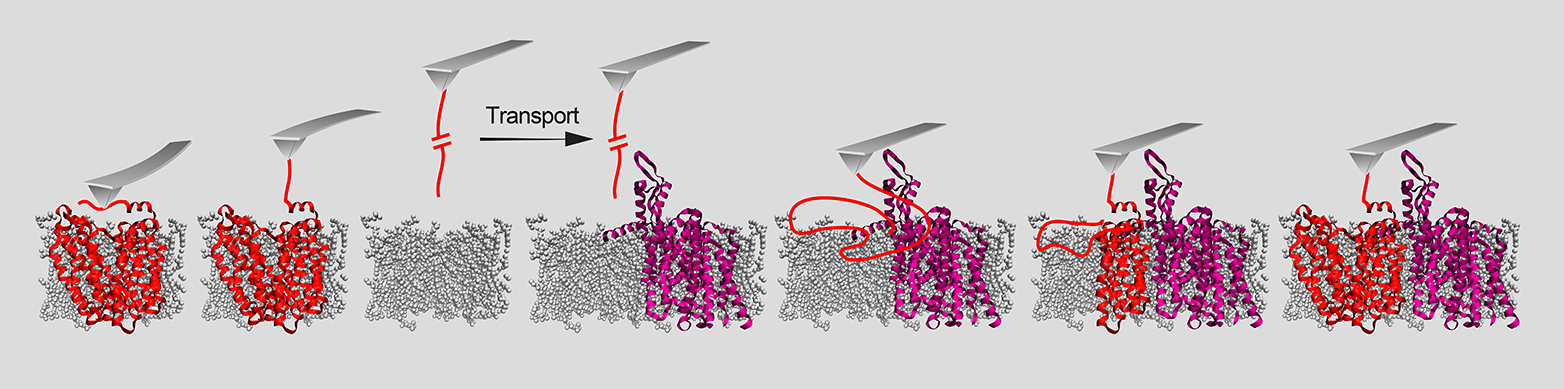
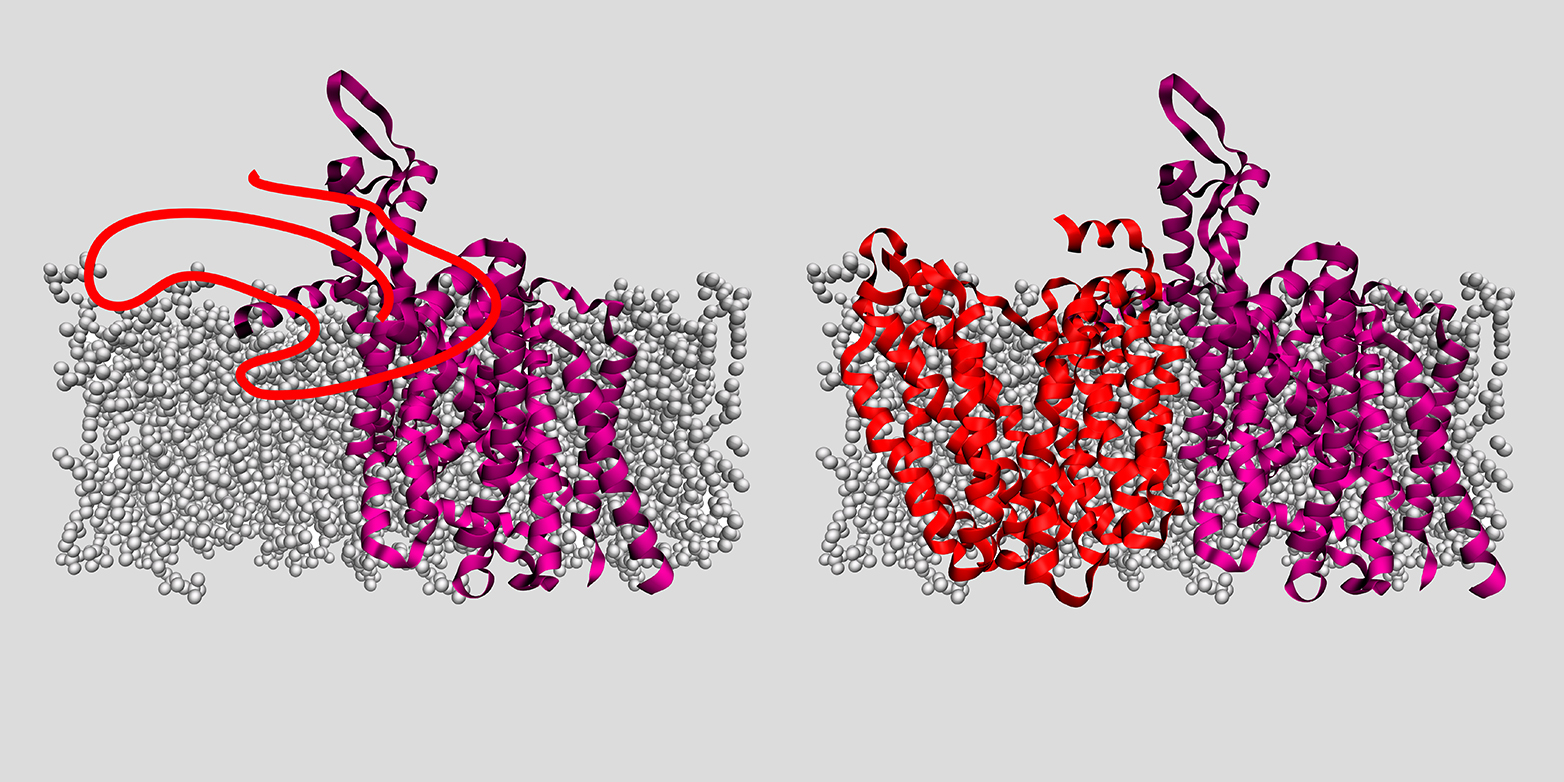
In Experimenten mit bakteriellen Proteinen konnten die Forschenden die Rolle von zwei Helferproteinen aufklären, welche es den Membranproteinen ermöglichen, sich in die Membran einzufügen: einer sogenannten Insertase und einer Translokase. Ersteres ist ein Protein, letzteres ein Komplex aus mehreren Proteinen. Beide sorgen dafür, dass sich in der Membran eine Pore öffnet. «Im Fall der Insertase kann man sich diese Pore als Rutschbahn vorstellen. Das Membranprotein liegt zunächst als unstrukturierter Peptid-Faden vor, der auf dieser Rutschbahn in die Membran gleitet. In der Membran organisiert sich dieser Peptid-Faden dann zu seiner funktionellen dreidimensionalen Form», erklärt ETH-Professor Müller. «Ist das Membranprotein schliesslich erfolgreich dreidimensional geformt und in der Membran verankert, löst sich das Helferprotein los und bildet an anderer Stelle in der Membran eine Rutschbahn für das nächste Protein.»
Wie diese Helferproteine funktionieren, wurde bisher nur ungenau und nur mit sehr kleinen Proteinbruchstücken oder ausserhalb von Biomembranen untersucht. «Wir haben nun zum ersten Mal Schritt für Schritt beobachtet und beschrieben, wie sich ein ganzes Protein in eine Membran einfügt und dreidimensional formt», sagt Tetiana Serdiuk, Postdoc in der Gruppe von ETH-Professor Müller und Erstautorin der Studie.
Dabei konnten die ETH-Forschenden auch die unterschiedlichen Arbeitsweisen von Insertasen und Translokasen aufzeigen: Insertasen fügen Peptid-Fäden verhältnismässig schnell, jedoch unkoordiniert in die Membran ein. «Sie machen daher besonders bei kleinen Proteinen einen guten Job», so Müller. Translokasen hingegen fügen Peptid-Fäden Abschnitt für Abschnitt in die Membran ein und sind daher bei komplexeren Proteinen besser geeignet.
Zentral für die Medizin
Bei dieser Studie handelt es sich um klassische Grundlagenforschung, die besonders wichtig ist angesichts der Bedeutung von Membranproteinen für die Medizin, wie Müller betont: «Rund die Hälfte aller Medikamente wirken auf Membranproteine, und wir müssen verstehen, wie sich diese Membranproteine formen und wie sie funktionieren.»
Ausserdem könnte die Einzelmolekül-Kraftspektroskopie, welche die ETH-Wissenschaftler für diese Studie weiterentwickelten, in zusätzlichen Anwendungen zum Zug kommen: Im Rahmen des Nationalen Forschungsschwerpunkts «Molecular Systems Engineering» arbeiten Müller und weitere Wissenschaftler an der Entwicklung künstlicher biologischer Zellen. «Die Methode könnte verwendet werden, um Membranhüllen massgeschneidert mit Proteinen zu bestücken und damit zu ‹programmieren›», so der ETH-Professor. «Solche künstlichen Zellen könnten dereinst als molekulare Fabriken für die industrielle Produktion von medizinischen Wirkstoffen eingesetzt werden.»
Literaturhinweis
Serdiuk T, Anja Steudle A, Mari SA, Manioglu S, Kaback HR, Kuhn, A, Müller DJ: Insertion and folding pathways of single membrane proteins guided by translocases and insertases. Science Advances 2019, 5: eaau6824, doi: externe Seite 10.1126/sciadv.aau6824
Kommentare
Noch keine Kommentare