Grippevirus trickst Abfallwesen aus
Für ihre eigene Vermehrung brauchen Viren die Zellmaschinerie. Wie die Erreger in Zellen eindringen, ist mittlerweile gut erforscht. Nur ungenügend bekannt ist hingegen, wie im Lauf der Infektion die Virenhülle geknackt wird, damit das Erbgut des Virus‘ freikommt. Ein Forschungsteam unter der Führung der ETH Zürich hat den Mechanismus nun beim Grippevirus aufgeklärt – und dabei Überraschendes zu Tage gefördert.
Die Infektion mit einem Virus läuft stets nach einem ähnlichen Schema ab. Der Erreger muss versuchen, in die Wirtszellen hineinzukommen, um deren Replikations- und Proteinbildungsmaschinerie für die eigene Vervielfältigung zu nutzen. Die erste Grenze, die ein Virus überwinden muss, ist die Zellmembran.
Dazu dockt das Virus auf der Oberfläche an und signalisiert der Zelle, dass es in ihr Inneres aufgenommen werden will. Die Zelle schnürt in der Folge ein Bläschen ab. Dieses enthält das Virus und transportiert es in Richtung Zellkern. Auf dieser Reise sorgt die Zelle dafür, dass die Lösung im Bläschen immer saurer wird. Der saure pH-Wert ermöglicht schliesslich die Verschmelzung der äusseren Virenhülle mit der Bläschenmembran.
Kapsid als Knacknuss
Das ist aber erst die halbe Miete. Denn das Grippevirus wie auch andere RNA-Viren haben ein weiteres Hindernis zu überwinden, ehe ihr genetischer Code freikommt: Die wenigen RNA-Stücke, die das Genom des Grippevirus ausmachen, sind in einem sogenannten Kapsid verpackt. Dieses stellt während der Übertragung von Zelle zu Zelle die Stabilität des Virus‘ sicher und schützt die Virusgene vor frühzeitigen Abbau.
Bisher hat man kaum verstanden, wie das Kapsid des Grippe-Virus‘ geknackt wird. Ein Team von Forschern der ETH Zürich, des Friedrich Miescher Institute for Biomedical Research in Basel und dem Biological Research Center in Szeged (Ungarn) hat nun eine Antwort auf diesen zentralen Aspekt der Grippeinfektion gefunden: Das Kapsid des Influenza-A-Virus‘ imitiert einen Knäuel aus Proteinabfällen, dem sogenannten Aggresom, das entwirrt und entsorgt werden soll. Dadurch getäuscht unterstützt der zelleigene Abfallbeseitigungskomplex das Knacken des Kapsids. Diese neue Erkenntnis wurde soeben in «Science» veröffentlicht.
So trägt das Virus-Kapsid molekulare Abfallmarken der Zelle auf seiner Oberfläche. Diese Abfallmarke namens Ubiquitin ruft ein Enzym auf den Plan, eine sogenannte Histon-Deacetylase (HDAC6), die an Ubiquitin bindet. HDAC6 bindet gleichzeitig Gerüst- und Motorproteine, die durch Zug den vermeintlichen «Abfallkomplex» auseinander zerren und der Entsorgung zuführen. Durch diese mechanische Arbeit zerreisst das Kapsid, sodass das genetische Material des Virus‘ frei kommt. Dank ihrer geringen Grösse passen die RNS-Erbmoleküle durch die Poren des Zellkerns. Dort angelangt beginnt die Zelle, die Viren-Gene zu vervielfältigen und neue Virenproteine zu bauen.
Getäuschte Abfallentsorgung
Für die Forscher war dieser Mechanismus eine grosse Überraschung. Das Abfallentsorgungssystem einer Zelle ist zentral, um Proteinabfall zu eliminieren. Kann die Zelle diese Müll-Eiweisse, die aufgrund von Hitze oder Stress entstehen, nicht schnell genug entsorgen, bildet der Abfall Aggregate. Um die Aggregate loszuwerden, mobilisiert die Zelle ihre Maschinerie, die Klumpen in Einzelteile zerlegt und abbaut. Genau diesen Mechanismus nützt das Grippevirus aus.
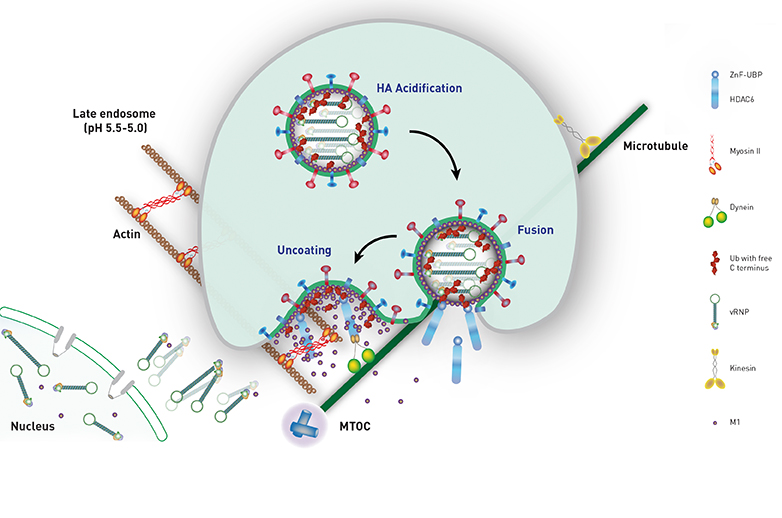
Überrascht waren die Forscher jedoch auch darüber, wie lange es dauert, bis sich das Kapsid öffnen lässt: rund 30 Minuten. Die gesamte Infektionsdauer vom Andocken auf der Zelloberfläche bis zum Eintritt der RNS in den Zellkern dauert zwei Stunden. «Der Vorgang dauert länger und ist komplexer, als wir erwartet haben», sagt Yohei Yamauchi, Postdoc bei ETH-Professor Ari Helenius, der HDAC6 aufspürte, und zwar mit einem Screeningverfahren von menschlichen Proteinen, die er daraufhin prüfte, ob das Virus sie braucht. Der Erstautor der Studie, Indranil Banerjee, bestätigte in seiner Folgestudie schliesslich, dass HDAC6 tatsächlich für die Kapsidöffnung zentral ist.
Die endgültige Antwort erhielten die Forschenden dank eines Mausmodells. Fehlte einer Mauslinie das Protein HDAC6, so war die Grippeinfektion viel schwächer: Den Grippeviren fehlte der zentrale Verankerungspunkt für die Anbindung an das Abfallentsorgungssystem. Dennoch ist das Fehlen von HDAC6 kein vollständiger Schutz.
Anbindung von Abfallmarke verhindern
Mit ihrer Studie haben die Forscher um Biochemieprofessor Ari Helenius Neuland beschritten. Es gebe kaum Studien zu der Frage, wie ein tierisches Virus sein Kapsid öffne. Dabei sei dies einer der wichtigsten Schritte während einer Infektion, sagt der Virologe. «Wir haben die Komplexität, die mit dem Auspacken des Kapsids einhergeht, allerdings unterschätzt», räumt Helenius ein. Er selbst habe vor 20 Jahren darüber eine Arbeit geschrieben, das Thema aber nicht weiter verfolgt. Gelungen sei es nun, da man über neue systemische Ansätze verfüge, um solche komplexe Systeme zu erforschen.
Ob sich die Erkenntnis therapeutisch nutzen lässt, ist noch offen, da das Fehlen von HDAC6 die Infektion nur mildert, aber nicht ganz verhindert. Die bisher bekannten Hemmstoffe gegen HDAC6 zielen auf seine zwei aktiven Bereiche ab. Die Blockade der enzymatischen Tätigkeit hilft aber nicht, die Anbindung von HDAC6 an die Abfallmarke Ubiquitin zu verhindern. «Da müsste man schon einen Stoff finden, der die Ubiquitin-Bindestelle blockiert», sagt Yamauchi. Auf Grund der Struktur von HDAC6 scheint dies aber möglich und solche weiterführende Experimente sind bereits geplant.
Rasche Mutationen erschweren Bekämpfung
Damit zeigt sich auch eine grundsätzliche Schwierigkeit der Virenbekämpfung. Geschickt nützen sie viele für die Zelle essenzielle Lebensvorgänge aus, so dass diese nicht einfach ausgeschaltet werden können. Tut man es trotzdem, drohen schwere Nebenwirkungen. Weiter mutieren Viren äusserst schnell. Im Fall des Grippemittels Tamiflu half dem Influenza-Virus eine Mutation, um das Zielprotein für den Wirkstoff auf seiner Oberfläche zu verändern, und das Medikament wurde nutzlos.
Möglicherweise ist der nun gefundene Mechanismus universell. Andere Viren könnten ihn ebenso oder in ähnlicher Weise einsetzen, um ihre Kapside zu öffnen und so Zellen effizient zu infizieren. Ari Helenius wird an diesem Thema allerdings nicht mehr weiter forschen: Er wird emeritiert und seine Gruppe an der ETH Zürich wird aufgelöst.
Literaturhinweis
Banerjee I, Miyake Y, Nobs SP, Schneider C, Horvath P, Kopf M, Matthias P, Helenius A, Yamauchi Y. Influenza A virus uses the aggresome processing machinery for host cell entry. Science, published online 24th October 2014. DOI: externe Seite 10.1126/science.1257037
Kommentare
Noch keine Kommentare