Wie mehrzellige Cyanobakterien Moleküle transportieren
Forscherinnen und Forscher der ETH Zürich und der Universität Tübingen klären hochaufgelöst die Struktur und Funktion von Zell-Zell-Verbindungen bei fädigen mehrzelligen Cyanobakterien auf. Damit können sie nun erklären, wie diese Mikroorganismen den Transport von verschiedenen Stoffen zwischen einzelnen Zellen regulieren.

Cyanobakterien, auch als Blaualgen bekannt, sind eine spezielle Klasse von Bakterien, die Photosynthese betreiben können. Entwicklungsgeschichtlich sind sie uralt. Vorläufer traten bereits vor 2,5 Milliarden Jahre auf der Erde auf und ebneten dank ihrer Fähigkeit der Sauerstoff erzeugenden Photosynthese höherem Leben den Weg.
Einige Cyanobakterien-Arten sind fädige, mehrzellige Organismen, in denen eine gewisse Arbeitsteilung herrscht. So betreiben die einen Zellen Photosynthese, andere nehmen Luftstickstoff auf. Durch Photosynthese gewinnen die Cyanobakterien Energie in Form von Glukose, den Stickstoff verwenden sie, um Aminosäuren, die Bausteine von Proteinen, zu produzieren.
Den Cyanobakterien stellt sich das Problem, wie die einzelnen Zellen miteinander kommunizieren und Stoffe austauschen können. Photosynthese betreibende Zellen müssen nämlich ihre stickstofffixierenden Schwesterzellen mit Glukose versorgen, in umgekehrter Richtung müssen Aminosäuren transportiert werden. Dazu haben Cyanobakterien spezielle Zellverbindungen entwickelt. Diese erlauben den Austausch von Nähr- und Botenstoffen über die Zellgrenzen hinweg, ohne dass die Zellen miteinander verwachsen sind.
Struktur in zellulärem Kontext aufgeklärt
Über den detaillierten Aufbau und das genaue Funktionieren der Zellverbindungen bei mehrzelligen fädigen Cyanobakterien war bislang nur wenig bekannt. Eine Gruppe von Forschenden der ETH Zürich und der Universität Tübingen stellt nun in der neuen Ausgabe der Fachzeitschrift «Cell» strukturelle Feinheiten und Funktionsweise der Zell-Zell-Verbindungen, sogenannten Septalverbindungen, bei der Gattung Anabaena in bisher unerreichter Auflösung vor.
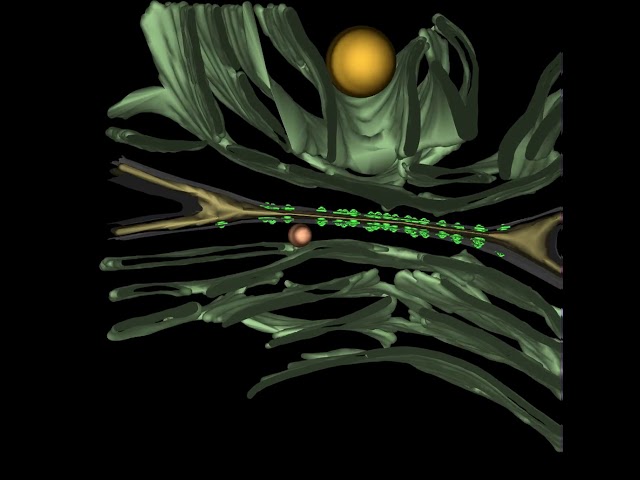
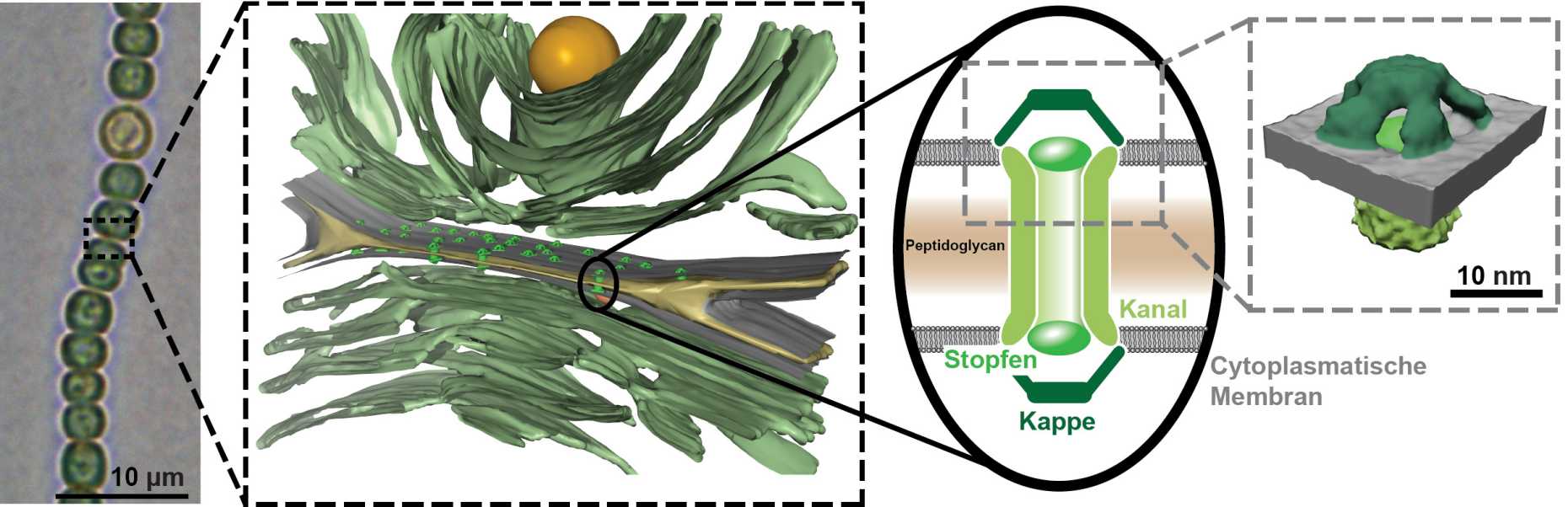
So zeigen die Forschenden, dass die Verbindungskanäle aus einer Proteinröhre bestehen, die an beiden Enden mit einem Stopfen verschlossen werden kann. Zudem ist diese Röhre überdacht mit fünfarmigen Protein-Elementen, die ähnlich einer Kamerablende angeordnet sind.
Die Kanäle verbinden die Cytoplasmen der beiden benachbarten Zellen und reichen dabei durch die jeweiligen Membranen und Zellwände hindurch. Die Zellen sind durch einen hauchdünnen Spalt von wenigen Nanometern Breite voneinander getrennt.
«Mit herkömmlicher Elektronenmikroskopie konnte man diese Details bisher nicht klären. Dank einer Erweiterung der Kryo-Elektronenmikroskopie ist es uns gelungen, Einblicke in bislang unerreichter Genauigkeit zu erhalten», sagt Martin Pilhofer, Professor am Institut für Molekularbiologie und Biophysik der ETH Zürich.
Pilhofers Doktorand Gregor Weiss entwickelte ein Verfahren, um die Cyanobakterien so zu präparieren, dass die Kanäle mittels Kryo-Elektronenmikroskopie sichtbar gemacht werden konnten. Dazu «fräste» Weiss in gefrorenen Cyanobakterien die Verbindungsstelle zwischen zwei Zellen schichtweise ab, bis seine Probe dünn genug war. Die kugeligen Zellen wären ohne Vorbehandlung für eine Anwendung in der Kryo-Elektronenmikroskopie zu dick.
«Aufgrund der komplexen Struktur der Verbindungskanäle vermuteten wir einen Mechanismus, der die Kanäle öffnet und schliesst», sagt Karl Forchhammer, Professor für Mikrobiologie an der Universität Tübingen. Tatsächlich konnte er zusammen mit seinem Team nachweisen, wie die Zellen des Verbands unter verschiedenen Stressbedingungen miteinander kommunizieren. Dazu färbten sie Cyanobakterien-Ketten mit einem fluoreszierenden Farbstoff ein und bleichten dann einzelne Zellen gezielt mit einem Laser. Danach massen die Forscherinnen den Einstrom des Farbstoffs aus Nachbarzellen.
Mithilfe dieser Methode konnten die Forschenden zeigen, dass die Kanäle bei Behandlung mit Chemikalien oder im Dunkeln tatsächlich dichtmachen. Dabei verschliesst sich die filigrane Kappenstruktur eines Kanals wie eine Irisblende und unterbricht den Stoffaustausch zwischen den Zellen, was die Wissenschaftler an unterschiedlich starker Fluoreszenz erkannten.
Schliessmechanismus schützt Zellverband
«Ein solcher Schliessmechanismus schützt den gesamten Zellverband», sagt Forchhammer. So könne eine Zelle verhindern, dass sie beispielsweise Schadstoffe an ihre Nachbarzellen weitergebe, was den gesamten Organismus zum Absterben bringen könnte. Auch können die Cyanobakterien mithilfe der Kanäle verhindern, dass bei mechanischer Beschädigung einzelner Zellen der Inhalt des gesamten Verbundes ausläuft.
Mit ihrer Studie können die Forschenden aufzeigen, dass Zellverbindungen in mehrzelligen nicht näher verwandten Organismen im Lauf der Evolution mehrmals «erfunden» wurden und sich parallel entwickelten. «Dies unterstreicht, wie wichtig es ist, dass ein mehrzelliger Organismus den Warentransport zwischen einzelnen Zellen kontrollieren kann», sagt Pilhofer. Mit der Klärung der Kanalstruktur und –funktion bei Cyanobakterien fügen die ETH-Forscher dem Gesamtbild ein weiteres Puzzleteil hinzu. «Für uns ist diese Arbeit biologische Grundlagenforschung ohne Fokus auf eine mögliche Anwendung. Vielmehr erlauben uns die neuen Daten Einblicke in die Evolution komplexer Lebewesen», erklärt der ETH-Professor.
Literaturhinweis
Weiss GL, Kieninger A-K, Maldener I, Forchhammer K, Pilhofer M. Structure and function of a bacterial gap junction analog. Cell, 2019, July 11th. DOI externe Seite 10.1016/j.cell.2019.05.055
Kommentare
Noch keine Kommentare