Wie sich die Lunge gegen Viren wehrt
Bei der Abwehr von Grippeviren spielen bestimmte Fresszellen in der Lunge eine wichtige Rolle. Diese sorgen dafür, dass die Atmung weiterhin funktioniert, selbst wenn das Lungengewebe angegriffen ist. Das zeigen zwei neue Studien von Forschern der ETH.
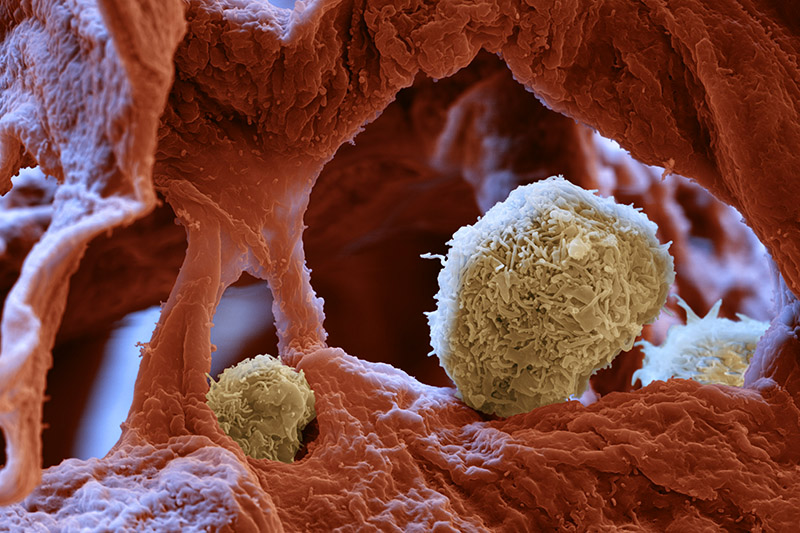
Bei einer schweren Grippeinfektion mit Influenza Viren leiden Patienten häufig unter Atemnot. Denn das Virus schädigt das Lungengewebe, sodass beim Atmen weniger Sauerstoff aus der Luft in den Körper gelangt. In schweren Fällen kann das zum Tod führen. Wie das angeborene Immunsystem die Lungenfunktion bei Virusinfektionen aufrecht erhält, haben nun Forscher um Manfred Kopf vom Institut für Molekulare Gesundheitswissenschaften der ETH Zürich an Mäusen untersucht. Eine entscheidende Rolle spielt dabei ein bestimmter Typ von Immunzellen, die sogenannten alveolären Makrophagen. «Sie sind absolut überlebenswichtig», sagt Manfred Kopf. Im Experiment infizierten die Forscher Mäuse mit dem Grippevirus vom Typ H1N1. Während normale Mäuse die Infektion überlebten, starben gentechnisch veränderte Tiere, denen die alveolären Makrophagen fehlten. Der Grund: Ihre Lungenfunktion war so stark eingeschränkt, dass sie nicht mehr genug Sauerstoff bekamen.
Alveoläre Makrophagen sind spezialisierte Fresszellen, die in den Lungenbläschen sitzen. Hierher können Krankheitserreger gelangen, die mit der Luft eingeatmet werden. Sie verfangen sich im Schleim, der die Oberfläche der Lungenbläschen bedeckt. Bisher ging man davon aus, dass die alveolären Makrophagen vor allem vor Bakterien und Pilzen schützen, indem sie diese zusammen mit dem Schleim auffressen. «Dass sie den Organismus jedoch vor den lebensbedrohlichen Komplikationen einer Grippeinfektion bewahren, ist neu», sagt Kopf.
Zelluläre Staubsauger
Das tun die Makrophagen allerdings auf indirekte Weise: Sie bekämpfen nicht das Virus selbst, sondern beseitigen Trümmer von Zellen, die durch das Virus zerstört wurden. «Sie funktionieren wie ein Art Staubsauger, indem sie die Lunge von Schmutz befreien», so der Immunologe. Fehlen die Fresszellen, verstopfen Zelltrümmer und Schleim die Lungenbläschen und behindern die Atmung. Das liess sich im Experiment anhand von Mikroskopaufnahmen der Lunge sowie von Sauerstoffmessungen im Blut nachweisen. Die Ergebnisse ihrer Studie haben die ETH-Forscher im April diesen Jahres in der Zeitschrift PLOS Pathogens veröffentlicht.
In einer nachfolgenden Studie, welche soeben in der Zeitschrift «Nature Immunology» erschienen ist, untersuchten Kopf und sein Team, wie die alveolären Makrophagen überhaupt entstehen. Bisher glaubte man, dass sie wie alle anderen Zellen des Immunsystems aus Stammzellen im Knochenmark gebildet werden und von dort über das Blut im Laufe des Lebens in die Lungenbläschen einwandern. Die ETH-Forscher konnten nun an Mäuse-Embryonen nachweisen, dass diese Annahme falsch ist. «Die Vorläufer der alveolären Makrophagen wandern bereits kurz vor der Geburt aus der Leber in die Lunge, wo sie nach der Geburt zu funktionstüchtigen Fresszellen ausreifen », sagt Manfred Kopf. Die ausgewachsenen Zellen können sich dann in der Lunge während des ganzen Lebens selbst erneuern.
Ansatzpunkt zur Behandlung von Grippe
Welche Moleküle für diesen Reifeprozess notwendig sind, konnten die Forscher ebenfalls entschlüsseln. Frühere Studien anderer Forschungsgruppen hatten bereits Hinweise darauf gegeben, dass der Wachstumsfaktor GM-CSF eine wichtige Rolle spielt. Dieser wird von den Epithelzellen in den Lungenbläschen gebildet und wirkt als Botenstoff, der an die Makrophagen bindet und in ihnen ein Signalmolekül mit dem Namen PPARgamma aktiviert, welches hunderte von anderen Genen steuert. «Das war eine Überraschung», sagt Kopf. Denn PPARgamma war bisher hauptsächlich dafür bekannt, den Stoffwechsel von Fettzellen und die Empfindlichkeit gegenüber Insulin zu regulieren. Bestimmte Medikamente gegen Altersdiabetes, so genannte Thiazolidindione, setzen an diesem Molekül an.
Diese liessen sich möglicherweise zukünftig auch zur Behandlung von Grippe nutzen, hofft der Forscher. Denn durch die Aktivierung von PPARgamma könne die Reifung von alveolären Makrophagen unterstützt und so das Immunsystem gestärkt werden. «Das könnte die Lungenfunktion von Patienten verbessern und ihnen helfen, die Krankheit zu überwinden», sagt Kopf. Das sei aber noch Spekulation, da bisher keine Studien dazu mit Menschen durchgeführt wurden.
Literaturhinweis
Schneider C, Nobs SP, Kurrer M, Rehrauer H, Thiele C, Kopf M. Induction of the nuclear receptor PPAR-g by the cytokine GM-CSF is critical for the differentiation of fetal monocytes into alveolar macrophages. Nature Immunology, Online-Publikation vom 28. September 2014. doi: externe Seite 10.1038/ni.3005
Schneider C, Nobs SP, Heer AK, Kurrer M, Klinke G, van Rooijen N, Vogel J, Kopf M. Alveolar Macrophages Are Essential for Protection from Respiratory Failure and Associated Morbidity following Influenza Virus Infection. PLOS Pathogens, Online-Publikation vom 3. April 2014. doi: externe Seite 10.1371/journal.ppat.1004053
Kommentare
Noch keine Kommentare