Wie Blutgefässe im Gehirn wachsen
Thomas Wälchlis Ziel ist es, das Wachstum von Hirntumoren zu bremsen. In seiner Doktorarbeit an der ETH Zürich beschäftigte sich der Mediziner mit der Entstehung von Blutgefässen im Gehirn. Denn diese unterstützen auch das Tumorwachstum. Der Wissenschaftler entwickelte eine Methode, die neue Einblicke in die einzelnen Entwicklungsschritte von Blutgefässen im Gehirn ermöglicht.
Blutgefässe sind essentiell für die Versorgung des Körpers mit Sauerstoff und Nährstoffen. Sie bilden ein Transportsystem, über welches das Blut zu den einzelnen Organen und Zellen gelangt. Der Arzt Thomas Wälchli hat in seiner naturwissenschaftlichen Doktorarbeit am Departement Gesundheitswissenschaften und Technologie (D-HEST) der ETH Zürich die komplexen Prozesse der Blutgefässbildung im Gehirn, einem der meist durchbluteten Organe des Körpers, erforscht.
Für seine Arbeit hat er ein Mikroskopie-Verfahren so weiterentwickelt, dass sich damit die sich neu formierenden und noch nicht durchbluteten von den durchbluteten Blutgefässen im Gehirn unterscheiden und dreidimensional darstellen lassen. Das ist deshalb wichtig, weil sich die nicht-durchbluteten Gefässteile noch im Wachstum befinden. Und eben dieser Wachstumsprozess könnte in Zukunft Ansatzmöglichkeiten für die Behandlung von Hirntumoren bieten.
Unterschiedliche Rolle von Blutgefässen
Blutgefässe erfüllen im Hirnraum mehrere Funktionen. Ihre Hauptaufgabe ist die Versorgung des Gehirngewebes mit Sauerstoff. Daneben spielen sie aber auch eine entscheidende Rolle bei Krankheiten wie Schlaganfällen, Hirnblutungen und Tumoren. Während nach einem Schlaganfall oder einer Hirnblutung neue Gefässe zur Genesung beitragen, haben die Blutgefässe bei Tumoren den gegenteiligen Effekt. «Sie versorgen die Tumorzellen mit Nährstoffen und Sauerstoff und fördern so das Tumorwachstum», erklärt Wälchli. Dem möchte er künftig etwas entgegensetzen können. Denn als Assistenzarzt in der Neurochirurgie am Universitätsspital Zürich hat er häufig mit Patienten mit Hirntumoren zu tun.
Für seine Dissertation untersuchte Wälchli die Blutgefässentwicklung im Gehirn von Mäusen in den Tagen nach der Geburt. In dieser Phase ist die Blutgefässbildung am aktivsten. Mit zunehmendem Alter werden immer weniger neue Blutgefässe gebildet bis die Blutgefässbildung im erwachsenen, gesunden Hirn praktisch ruht.
Der Entwicklungsprozess läuft dabei primär so ab, dass neue Gefässe aus den bereits bestehenden herauswachsen. An der Spitze eines neuen Gefässzweigs befindet sich eine sogenannte Tip-Zelle, die mit fingerähnlichen Zellfortsätzen (Filopodien) gewissermassen das umliegende Gewebe nach Signalen sondiert. Abhängig von mechanischen und metabolischen Rückkopplungen sowie weiteren, bislang nicht vollständig erforschten Faktoren dirigiert die Tip-Zelle den wachsenden Gefäss-Spross durch das Gewebe und verschmilzt schliesslich mit einem anderen Gefäss – es entwickelt sich ein neuer durchbluteter Gefässzweig.
Blutgefässe sichtbar machen
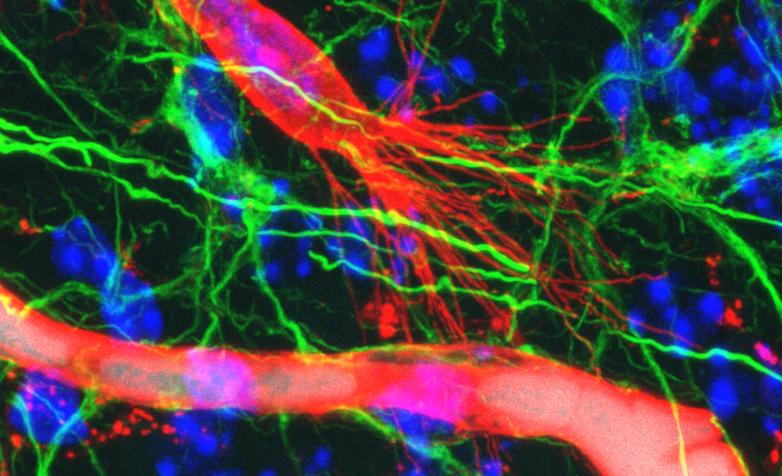
Mit der von Thomas Wälchli und Kollegen an ETH, Universität und Universitätsspital Zürich entwickelten sogenannten Immunfluoreszenz-Methode lassen sich jetzt erstmals die durchbluteten sowie die nicht-durchbluteten Gefässe inklusive Tip-Zellen präzise und vor allem zeitgleich in einem Gewebepräparat abbilden. «Die Idee war dabei, die bestehende Technik zur Darstellung der durchbluteten Gefässe mit der Visualisierung der Tip-Zellen zu kombinieren», berichtet Wälchli.
Die Methode funktioniert so: In einem ersten Schritt machen die Wissenschaftler die durchbluteten Blutgefässe mit Hilfe von Evans Blue sichtbar. Das ist ein Farbstoff, der an Albumin bindet, ein im Blutplasma vorkommendes Protein. In einem zweiten Schritt werden die nicht-durchbluteten Gefässe im Hirnpräparat mit einem Fluoreszenzfarbstoff kenntlich gemacht, der an Blutgefässwandzellen (Endothelzellen) bindet. Mit einem sogenannten konfokalen Fluoreszenzmikroskop können so detail- und kontrastreiche dreidimensionale Aufnahmen gemacht werden. Diese Bilder sind so präzise, dass sich bei jedem Gefäss das Entwicklungsstadium feststellen lässt.
Mit Hilfe der Stereologie, einer mathematischen Methode zur dreidimensionalen Bildanalyse, konnte Wälchli ausserdem das Volumen, die Länge sowie die Anzahl Verzweigungen der Gefässe exakt berechnen – und zwar sowohl für die durchbluteten als auch für die sich neu bildenden Gefässe. Zudem ermöglicht die Technik eine präzise Analyse der Tip-Zellen inklusive der Anzahl und Länge der Filopodien.
Ein Werkzeug für die Krebsforschung
Die Methode soll künftig etwa Forschungsarbeiten zu Signalmolekülen, welche die Blutgefässbildung fördern oder hemmen, erleichtern. So könnte sie dazu beitragen, Therapien für jene Krankheiten zu finden, bei denen die Blutgefässbildung eine Rolle spielt. «Denn viele Moleküle und Signalwege, welche für das Blutgefässwachstum während der Gehirn-Entwicklung wichtig sind, werden während dem Wachstum von Hirntumoren und der Regeneration nach Schlaganfällen reaktiviert», so der Mediziner.
Wälchli ist derzeit Assistenzarzt an der Klinik für Neurochirurgie am Universitätsspital Zürich und Junior Group Leader an den Zentren für Regenerative Medizin und für Neurowissenschaften von Universität und Universitätsspital Zürich beziehungsweise ETH Zürich. Zusammen mit seinen Kollegen ist er daran, die Methode so weiterzuentwickeln, dass damit das Wachstum von Blutgefässen in Hirntumoren charakterisiert werden kann. Dies wäre für die Suche nach Medikamenten hilfreich, welche Blutgefässe im Tumor, nicht aber im gesunden Gehirngewebe angreifen.
Literaturhinweis
Wälchli T, Mateos JM, Weinman O, Babic D, Regli L, Hoerstrup SP, Gerhardt H, Schwab ME, Vogel J: Quantitative assessment of angiogenesis, perfused blood vessels and endothelial tip cells in the postnatal mouse brain, Nature Protocols, 11. Dezember 2014, doi: externe Seite 10.1038/nprot.2015.002
Kommentare
Noch keine Kommentare