Chamäleon-Proteine machen einzelne Zellen sichtbar
Wissenschaftler entdeckten einen neuen Mechanismus, mit dem ein fluoreszierendes Protein seine Farbe ändern kann. Damit können sie in lebenden Organismen individuelle Zellen in ihrem dreidimensionalen Umfeld mikroskopisch sichtbar machen.
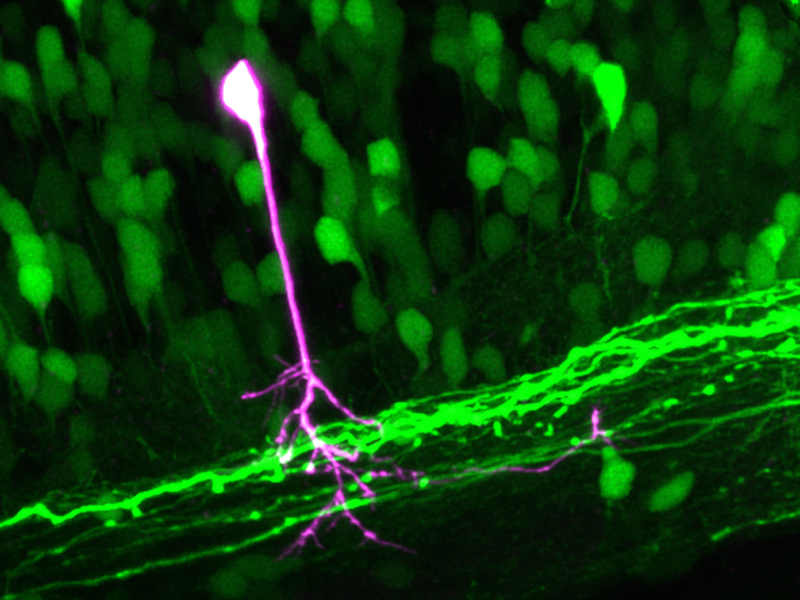
Forschende am Departement Biosysteme der ETH Zürich in Basel entwickelten eine Mikroskopie-Methode, die es erstmals ermöglicht, in lebenden Organismen individuelle Zellen innerhalb einer komplexen, dreidimensionalen Zellstruktur sichtbar zu machen. Damit gelang es den Wissenschaftlern, spektakuläre Mikroskopiebilder vom Nervensystem eines lebenden Zebrafisches zu machen, des «Modellfisches» der Wissenschaft. Auf den Bildern der ETH-Wissenschaftler sind motorische Nervenzellen im Rückenmark der Zebrafische zu sehen. Eine einzelne Nervenzelle mitsamt aller ihrer Zellfortsätze ist dabei in einer anderen Farbe hervorgehoben.
Am Anfang der Anwendung stand eine Beobachtung von William Dempsey, Postdoc in der Gruppe von ETH-Professor Periklis Pantazis. Er arbeitete mit einer speziellen Klasse von fluoreszierenden (leuchtenden) Proteinen (siehe Kasten). Die Proteine, die er untersuchte, sind insofern speziell, als dass sie ihre Farbe ändern, wenn sie mit Laser-Licht einer bestimmten Wellenlänge bestrahlt werden. Dendra 2 heisst eines dieser «Chamäleon-Proteine». Bestrahlen es die Wissenschaftler mit blauem Licht, leuchtet es grün. Regt man es hingegen mit intensiven violettem oder ultraviolettem Licht an, so wechselt es seine Farbe nach Rot.
Kombination zweier Laser
Was Dempsey und Pantazis entdeckten: Bestrahlt man Dendra 2 gleichzeitig mit blauen und rotem Licht, so ändert das Protein ebenfalls seine Farbe nach Rot. Für diese Kombinationsbestrahlung reicht eine geringe Lichtintensität aus, Zellen werden damit – anders als bei sehr intensiver violetter oder ultravioletter Bestrahlung – nicht geschädigt.
ETH-Professor Pantazis und seine Kollegen hatten in der Folge eine Idee, wie man diese Kombinationsbestrahlung in der Lichtmikroskopie nutzen kann. Fluoreszierende Proteine kommen dort zum Einsatz, um ganze Zellen, präzise Zellstrukturen oder einzelne Moleküle sichtbar zu machen. Die Entdeckung der ETH-Forscher ermöglicht es nun erstmals in einem lebenden Organismus, eine an einem gewünschten Ort liegende Zelle oder Moleküle farblich hervorzuheben, und gleichzeitig mit einer anderen Farbe die Gesamtheit der Zellen beziehungsweise Moleküle sichtbar zu machen.
Fokussierung auf einen Punkt
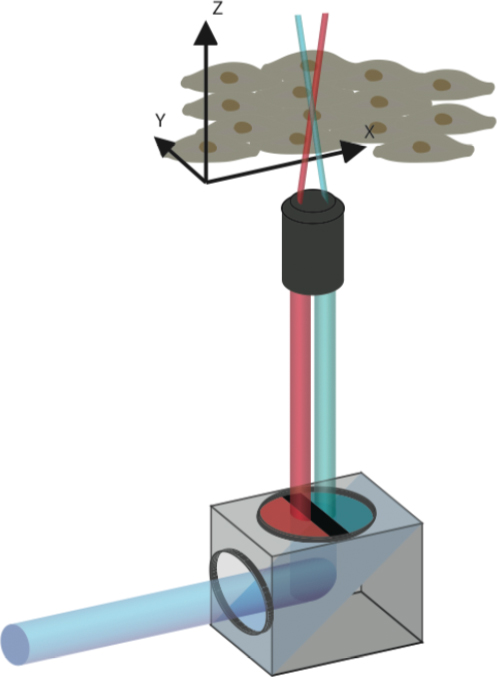
Der Plan der Wissenschaftler: Zwei verschiedene Laserstrahlen können – einzeln verwendet – die Farbe eines Chamäleon-Proteins nicht ändern. Kombiniert man die beiden Strahlen aber und ordnet sie so an, dass sie an einem bestimmten Punkt des Untersuchungsobjekts aufeinandertreffen, dann verändern die dort liegenden Proteine ihre Farbe. Die nicht mit beiden Lasern gleichzeitig aktivierten Proteine hingegen behalten ihre ursprüngliche Färbung.
Die Forschenden entwickelten dazu einen einfachen und kostengünstigen Farbfilter. Er kann mit herkömmlichen Konfokal-Laser-Mikroskopen verwendet werden, wie es sie in vielen biomedizinischen Forschungseinrichtungen gibt. Zwischen Laserquelle und Untersuchungsobjekt montiert, teilt der Filter das Laser-Licht in blaue und rote Teil-Strahlen, die sich auf einen winzigen Brennpunkt im Untersuchungsobjekt fokussieren.
Bewegte Prozesse untersuchen
Im Fall des Zebrafisches, der durchsichtig ist und sich daher besonders gut für die Mikroskopie eignet, markierten die ETH-Wissenschaftler dessen Nervenzellen mit Dendra 2. Anschliessend richteten sie den Brennpunkt des kombinierten Laserstrahls auf den Zellkörper einer einzelnen Nervenzelle im lebenden, anästhesierten Zebrafisch. Die dortigen Dendra-2-Moleküle wurden rot, verbreiteten sich in der ganzen Zelle und färbten auch die Fortsätze dieser einen Zelle. Alle anderen Zellen – insbesondere jene in der unmittelbaren Umgebung – blieben hingegen grün.
Einzelne Nervenzellen sichtbar machen zu können, sei beispielsweise für die präzise Kartierung des Gehirns von grosser Bedeutung, erklärt Pantazis. Weil sich die neue Technik für einzelne Zellen in lebenden Organismen eignet, könne man damit auch dynamische Prozesse untersuchen, zum Beispiel den Einfluss von pharmazeutischen Wirkstoffen auf Zellen oder Moleküle. Oder man könne damit die Embryonalentwicklung detaillierter untersuchen. «Unsere Methode ermöglicht dreidimensionale Analysen auf eine elegante Art», so der ETH-Professor. «Und sie ist ein schönes Beispiel, wie man mit einem Resultat aus der Grundlagenforschung eine Lösung für ein technisch anspruchsvolles Problem finden kann.» Pantazis hofft, dass die Technik in Zukunft in der biomedizinischen Forschung breit angewendet wird. Dazu ist er im Gespräch mit Mikroskop-Herstellern.
Fluoreszierende Proteine
Fluoreszierende Proteine sind aus der biomedizinischen Forschung nicht mehr wegzudenken: Wann immer ein Wissenschaftler eine Zellstruktur oder ein bestimmtes Molekül unter dem Mikroskop sichtbar machen möchte, färbt er die Zellstruktur oder das Molekül spezifisch mit einem solchen Protein ein. In der Natur kommen diese Proteine in bestimmten Quallen und Korallen vor. Mittlerweile haben Forschende eine ganze Farbpalette von synthetischen fluoreszierenden Proteinen geschaffen. Diese leuchten grün, orange, blau, rot oder gelb. Damit können auch unterschiedliche Zellstrukturen gleichzeitig sichtbar gemacht werden. Es gibt ausserdem Proteine, die erst leuchten, wenn man sie mit Licht einer bestimmen Wellenlänge bescheint. Wiederum andere wechseln bei Bestrahlung mit bestimmtem Licht ihre Farbe.
Literaturhinweis
Dempsey WP, Georgieva L, Helbling PM, Sonay AY, Truong TV, Haffner M, Pantazis P: In vivo single cell labeling by confined primed conversion, Nature Methods, 18. Mai 2015, doi: externe Seite 10.1038/nmeth.3405
Kommentare
Noch keine Kommentare