Wie ein legendäres Apfelbild die Verbesserung der Zellanalyse anregte
Unter mehreren Millionen Zellen eine kleine Zahl von Krankmachenden zu identifizieren, ist knifflig. Forscher der ETH Zürich haben nun eine Technologie weiterentwickelt, die riesige Mengen von Zelleigenschaften im kleinen Massstab detailgenau und einzeln erfassen kann.
Alle Lebensprozesse von Menschen, Tieren und Pflanzen sind abhängig von Zellaktivitäten. Allein der menschliche Körper umfasst über 210 Zelltypen mit bestimmten Eigenschaften und Funktionen, die seine Entwicklung und seine Gesundheit beeinflussen. Jede einzelne dieser Zellen und ihre Eigenschaften genau zu kennen, ist eine wichtige Grundlage für Biologie und Medizin. Die gesuchte Zellinformation herauszufiltern, ist manchmal eine gewaltige Herausforderung – besonders wenn von einer Million Zellen knapp ein Dutzend die Eigenschaft hat, die eine Krankheit auslöst.
Ein bewährtes Verfahren, wie Chemie, Biologie oder Medizin die Eigenschaften von einzelnen Zellen schnell und in grosser Anzahl feststellen, ist die Durchflusszytometrie. Mit dieser Zellmesstechnologie lassen sich zum Beispiel Krebszellen bestimmen oder T-Zellen, jene weissen Blutzellen, die für die Immunabwehr wichtig sind.
Erfunden wurde die Technologie 1968. Herkömmliche Durchflusszytometer messen normalerweise das Streulicht und die Fluoreszenz, wenn die Zellen durch einen Laserstrahl fliessen. Die resultierenden Signale unterscheiden sich in Abhängigkeit der Grösse, Form, Struktur oder Färbung der Zellen. T-Zellen etwa sind sehr glatt und streuen weniger Licht als andere.
Gut kombiniert
Der Forschungsgruppe von Andrew deMello, ETH-Professor für Biochemische Ingenieurwissenschaften, ist es nun gelungen, die Durchflusszytometrie entscheidend weiterzuentwickeln. Ihre bildgestützte Zytometrie-Plattform misst die Zellen und ihre Eigenschaften schneller, in höheren Mengen und viel genauer als heutige Durchflusszytometer. Wie die Methode funktioniert, haben die ETH-Forscher soeben im Wissenschaftsjournal «Chem» dargelegt.
Den Ansatz haben die Forscher nicht neu erfunden. Vielmehr haben sie bestehende Technologien geschickt kombiniert: Ihr Durchflusszytometer verknüpft die Möglichkeiten der Mikrofluidik, die das mit Verhalten kleiner Mengen von Flüssigkeiten auf engstem Raum untersucht, mit hochempfindlichen optischen Erkennungsmethoden und ultraschneller Bildgebung.
Damit erzielen sie einen Ultra-Hochdurchsatz von über 50'000 Zellen pro Sekunde. Marktübliche, fluoreszenzbasierte Durchflusszytometer messen zuverlässig zwischen 100 und 20'000 Zellen pro Sekunde; mikrofluidische Durchflusszytometer sogar nur bis zu 4000 Zellen pro Sekunde. In der Praxis werden jedoch normalerweise erheblich weniger Zellen vermessen, da diese sonst verklumpen.

«Wir entwickeln Technologien, damit Chemiker, Biologen und Mediziner neue Forschung betreiben können», sagt deMello. Von seiner Plattform verspricht er sich, dass sie künftig auch einfacher und viel preiswerter sein wird als die heutigen Apparaturen.
Im Prinzip besteht sein Duchflusszytometer aus drei Teilen: am Anfang werden die Zellen eng hintereinander aufgereiht. Ein Fluss aus Mikroflüssigkeiten führt sie dann durch einen schlangenlinienförmig gewundenen Mikrokanal (vgl. die Zeichnung oben) und in den Erkennungsbereich. Dort zeichnet eine hochauflösende Kamera ihre Grösse, Form und Struktur anhand der Lichteffekte auf. Zuletzt können sie nach ihren Eigenschaften sortiert werden.
Schnappschüsse auf Schlaufen
Ein Clou des Ansatzes ist, dass die Zellen mehrere parallele Schlaufen durchlaufen. So kann die Kamera eine grosse Zahl von Zellen präzis aufnehmen. Das beschleunigt deMellos Verfahren, und es ermöglicht die Ausführung bei ausserordentlich hohen Durchsätzen. «Die Kombination von Mikrofluidik mit Bildgebung ermöglicht die Anreicherung von Information», sagt er. In herkömmlichen Ansätzen hingegen registriert ein Detektor an einem bestimmten Punkt jeweils eine Zelle nach der anderen.
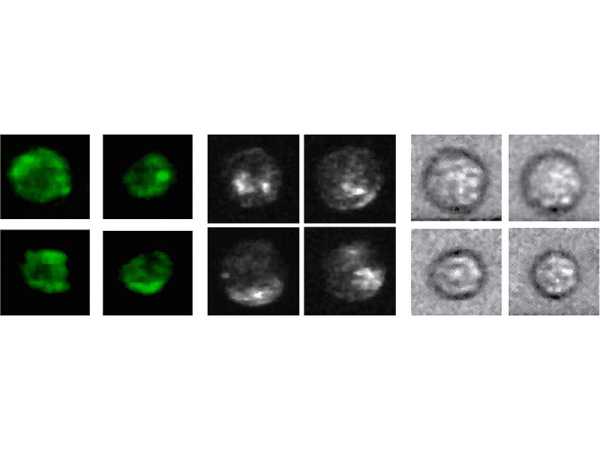
Drei Arten von Bildern lassen sich mit seiner Technologie gewinnen: Dunkelfeld-Bilder mit Information über Form und Struktur einer Zelle (diese Bilder zeigen farbige Strukturen vor einem dunklen Hintergrund), Hellfeld-Bilder mit Information über die Zellgrösse und leuchtfarbige Bilder mit Information zum Erscheinungsbild und der inneren Struktur einer Zelle. Besonders die Gewinnung morphologischer Information hebt deMellos Ansatz von anderen, fluoreszenz- oder mikrofluidbasierten Ansätzen ab.
Bildgebung wie bei «Papa Flash»
Bei einem Problem kam deMellos Gruppe die langjährige Erfahrung in der tröpfchenbasierten Mikrofluidik und bei optischen Methoden zugute: Wenn Tröpfchen, Zellen oder Kleinstpartikel sehr schnell fliessen, werden die Bildaufnahmen – wie bei Fotografien – mitunter verzerrt und unscharf.
Die Lösung des Problems entnahm die Forschungsgruppe der Geschichte: Zur Belichtung der Zellen setzen sie auf stroboskopische Belichtung, die den kontinuierlichen Fluss der Zellen – wie eine Zeitlupe – in eine Abfolge von Standbildern aufgliedert. Weltbekannt wurde diese Methode durch den Erfinder des Stroboskop-Blitzgeräts, Harold E. Edgerton, auch «Papa Flash» genannt. Seine Kultfotos aus den 1960er-Jahren gingen um die Welt.
Dank der stroboskopischen Belichtung lassen sich einzelne Zellen, die sich mit einem halben Meter pro Sekunde und in grossen Mengen bewegen, scharf aufnehmen.
Um die Leistungsfähigkeit ihrer Methode zu testen, hat deMellos Mitarbeiter Stavros Stavrakis zusammen mit zwei Studierenden eine grosse Zellpopulation untersucht und dabei lebende, sterbende und tote Zellen anhand ihrer Fluoreszenz unterschieden. In einem nächsten Schritt wollen die ETH-Forscher die Methode mit Blick auf bakterielle, nanowissenschaftliche und industrielle Anwendungen weiterentwickeln.
Literaturhinweis
Rane A S, Rutkauskaite J, deMello A, Stavrakis S. High-Throughput Multi-parametric Imaging Flow Ctyometry. Chem (2017), published online 12 October 2017. doi: externe Seite dx.doi.org/10.1016/j.chempr.2017.08.005
Bildergalerie



Kommentare
Noch keine Kommentare