Die Gehirnentwicklung kartieren
ETH-Forschende züchten aus Stammzellen menschliches gehirnähnliches Gewebe und kartieren die Zelltypen, die in verschiedenen Hirnregionen vorkommen, sowie die Gene, die deren Entwicklung regulieren. Das hilft bei der Erforschung von Entwicklungsstörungen oder Nervenerkrankungen.
Das menschliche Gehirn ist das wohl komplexeste Organ in der gesamten belebten Natur. Es fasziniert und beschäftigt die Forschung seit langem. Allerdings ist die Erforschung des Gehirns, insbesondere welche Gene und molekularen Schalter dessen Entwicklung regulieren und lenken, nicht ganz einfach.
Bislang haben Wissenschaftler:innen dazu Tiermodelle, vor allem Mäuse, verwendet, doch lassen sich die Erkenntnisse nicht eins zu eins auf den Menschen übertragen. Das Mäusegehirn ist anders aufgebaut, und es fehlt ihm die für das Gehirn des Menschen typische gefurchte Oberfläche. Auch Zellkulturen waren bislang nur bedingt geeignet, breiten sich die Zellen doch meistens nur flächig auf einem Kulturmedium aus, was der natürlichen dreidimensionalen Struktur des Gehirns nicht entspricht.
Molekulare Fingerabdrücke kartieren
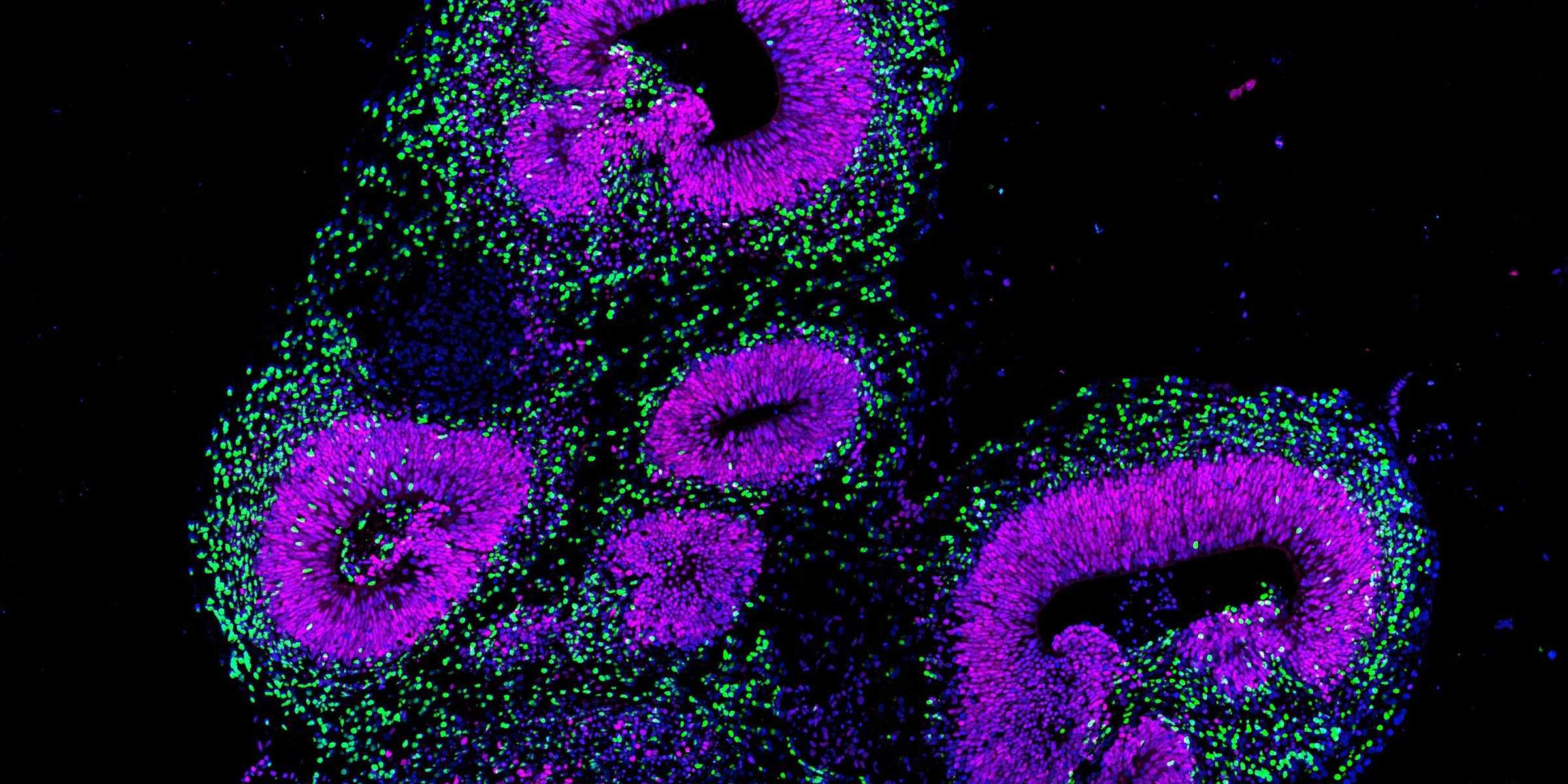
Eine Gruppe von Forschenden um Barbara Treutlein, ETH-Professorin am Departement Biosysteme in Basel, hat nun einen neuen Weg beschritten, um die Entwicklung des menschlichen Gehirns zu erforschen: Sie züchtet und nutzt Organoide, millimetergrosse dreidimensionale Gewebeklümpchen, die sich aus sogenannt pluripotenten Stammzellen heranziehen lassen.
Vorausgesetzt, diese Stammzellen erhalten den richtigen Stimulus, können Forschende sie so programmieren, dass sie zu jeder beliebigen Körperzelle werden, also auch zu Nervenzellen. Werden die Stammzellen in einem kleinen Gewebeball aggregiert und dann dem entsprechenden Stimulus ausgesetzt, können sich diese sogar selbstorganisieren und ein dreidimensionales Gehirn-Organoid mit einer komplexen Gewebearchitektur formieren.
In einer neuen Studie, die soeben in der Fachzeitschrift externe Seite Nature erschienen ist, haben nun Treutlein und ihre Mitarbeitenden tausende von einzelnen Zellen eines Gehirn-Organoids zu verschiedenen Zeitpunkten sehr detailliert molekulargenetisch charakterisiert, also die Gesamtheit aller Gen-Transkripte (Transkriptom) als Mass für die Genaktivität, aber auch die Zugänglichkeit des Genoms als Mass für die regulatorische Aktivität erfasst. Diese Daten konnten sie in einer Art Landkarte darstellen, auf welcher der molekulare Fingerabdruck jeder Zelle innerhalb des Organoids kartographiert ist.
Das Vorgehen erzeugt allerdings immense Datensätze: Jede Zelle des Organoids besitzt 20'000 Gene, jedes Organoid wiederum besteht aus vielen tausenden von Zellen. «Das ergibt eine gigantische Matrix, die wir nur mithilfe von geeigneten Programmen und Maschinellem Lernen lösen können», erklärt Jonas Fleck, Doktorand in der Treutlein-Gruppe und einer der Co-Erstautoren der Studie. Um die Daten zu analysieren und die Genregulationsmechanismen vorherzusagen, entwickelten die Forschenden ein eigenes Programm. «Damit können wir für jedes einzelne Gen ein ganzes Interaktionsnetzwerk erzeugen und vorhersagen, was beim Ausfall dieses Gens in den echten Zellen passiert», sagt Fleck.
Genetische Schalter identifizieren
Ziel dieser Studie war es, systematisch jene genetischen Schalter zu identifizieren, welche die Entwicklung der Nervenzellen in verschiedenen Regionen der Organoide massgebend beeinflussen.
Mithilfe eines Crispr/Cas-Systems schalteten die ETH-Forschenden in jeweils einer Zelle gezielt ein Gen aus, im gesamten Organoid an die zwei Dutzend Gene gleichzeitig. Damit konnten sie herausfinden, welche Rolle die jeweiligen Gene bei der Entwicklung des Gehirn-Organoids spielten.
«Mit diesem Verfahren kann man Gene, die in Krankheiten involviert sind, überprüfen. Zudem kann man schauen, welchen Effekt diese Gene auf die Entwicklung verschiedener Zellen innerhalb des Gehirn-Organoids haben», erklärt Sophie Jansen, die ebenfalls in der Gruppe von Treutlein doktoriert und zweite Co-Erstautorin der Studie ist.
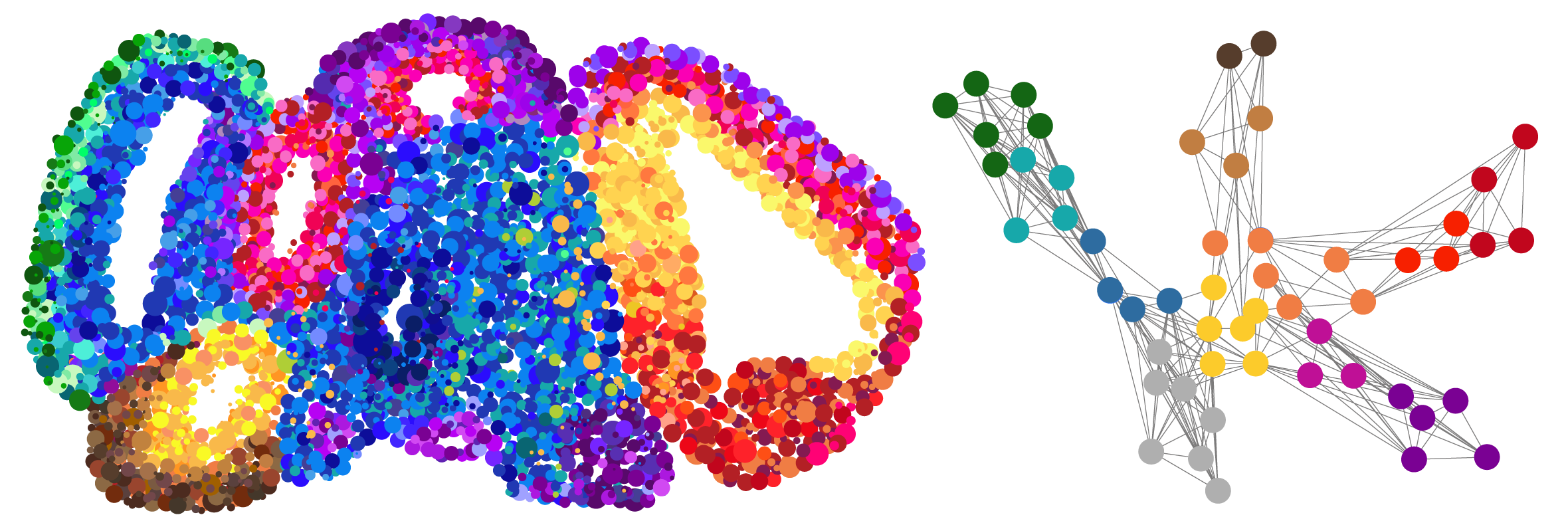
Musterbildung des Vorderhirns überprüft
Um die Theorie experimentell zu überprüfen, wählten die Forschenden exemplarisch das Gen GLI3 aus. Dieses Gen ist die Bauanleitung für den gleichnamigen Transkriptionsfaktor, ein Protein also, das sich an bestimmten Stellen des Erbguts andockt und damit ein anderes Gen reguliert. Dadurch kann die Zellmaschinerie dieses Gen nicht ablesen und in ein RNA-Molekül überschreiben (transkribieren).
Mutationen im Gen GLI3 führen bei Mäusen unter anderem zu Fehlentwicklungen im Zentralnervensystem. Seine Rolle in der neuronalen Entwicklung des Menschen war bislang nicht erforscht. Bekannt ist, dass Mutationen in dem Gen zu verschiedenen Krankheiten führen, wie der Greig Cephalopolysyndactylie oder dem Pallister-Hall-Syndrom.
Indem die Forschenden nun dieses GLI3-Gen stummschalteten, konnten sie einerseits ihre theoretischen Vorhersagen überprüfen, andererseits direkt in der Zellkultur feststellen, wie sich der Ausfall dieses Gens auf die weitere Entwicklung des Gehirn-Organoids auswirkte. «Wir konnten zum ersten Mal zeigen, dass das GLI3-Gen beim Menschen in die Bildung von Vorderhirnmustern involviert ist. Das war zuvor nur in der Maus gezeigt worden», sagt Treutlein.
Modellsysteme widerspiegeln Entwicklungsbiologie
«Das Aufregende an dieser Forschung ist, dass man die genomweiten Daten von so vielen einzelnen Zellen verwenden kann, um zu postulieren, welche Rolle die individuellen Gene spielen», erklärt sie. «Ebenso aufregend ist für mich, dass diese in der Petrischale hergestellten Modellsysteme wirklich Entwicklungsbiologie widerspiegeln, wie wir es aus der Maus kennen.»
Faszinierend sei, dass man in einem Medium ein selbstorganisiertes Gewebe mit Strukturen erhalte, die mit denen des menschlichen Gehirns vergleichbar seien. Nicht nur auf morphologischer Ebene, sondern auch – was die Forschenden in ihrer neusten Studie gezeigt haben – auf Stufe Genregulation und Musterbildung. «Solche Organoide kann man wirklich brauchen, um menschliche Entwicklungsbiologie zu erforschen», betont Treutlein.
Vielseitig einsetzbare Gehirn-Organoide
Die Forschung an Organoiden aus menschlichem Zellmaterial hat den Vorteil, dass die Erkenntnisse auf den Menschen übertragbar sind. Sie lassen sich nicht nur dafür nutzen, um grundlegende Entwicklungsbiologie zu erforschen, sondern auch die Rolle von Genen in Krankheiten oder Entwicklungsstörungen des Gehirns. So sind Treutlein und ihre Mitarbeitenden daran, die genetische Ursache von Autismus oder Heterotopia, bei der sich Nervenzellen nicht an der anatomisch üblichen Lokalisation in der Grosshirnrinde befinden, anhand von solchen Organoiden zu untersuchen.
Organoide können auch für das Wirkstoff-Screening genutzt werden, möglicherweise auch für die Zucht von transplantierbaren Organen oder Organteilen. Die Pharmabranche ist an solchen Zellkulturen stark interessiert, wie Treutlein bestätigt.
Allerdings ist die Aufzucht von Organoiden zeit- und arbeitsintensiv. Zudem entwickelt sich jedes Zellklümpchen individuell und nicht standardisiert. Treutlein arbeitet mit ihrem Team deshalb daran, die Organoide zu verbessern und den Herstellungsprozess zu automatisieren.
Human Cell Atlas
Die Erforschung und Kartierung der Gehirn-Organoide ist eingebettet in den «Human Developmental Cell Atlas»; dieser wiederum ist Teil des «externe Seite Human Cell Atlas». Mit dem Human Cell Atlas wollen Forschende weltweit alle Zellentypen des menschlichen Körpers kartieren sowie Daten darüber zusammentragen, wann in welchen Zellen welche Gene aktiv sind und welche Gene in Krankheiten involviert sein könnten. Die Leiterin des Human Cell Atlas ist MIT-Biologieprofessorin Aviv Regev, die 2021 den Ehrendoktortitel von der ETH Zürich erhalten hat. ETH-Professorin Barbara Treutlein co-koordiniert den Teilbereich «Organoid Cell Atlas». Dessen Ziel ist es, alle Zellstadien, die in Zellkultur hergestellt werden können, zu kartieren und mit den ursprünglichen Zellen des menschlichen Körpers zu vergleichen.
Literaturhinweis
Fleck JS, Jansen SMJ, Wollny D, Seimiya M, Zenk F, Santel M, He Z, Camp JG, Treutlein B. Inferring and perturbing cell fate regulomes in human brain organoids. Nature (2022), online publiziert 5. Oktober. Doi: externe Seite 10.1038/s41586-022-05279-8
Kommentare
Noch keine Kommentare