Mit AI zu neuen Arzneistoffen nach dem Vorbild der Natur
Artificial Intelligence (AI) kann gezielt die biologische Aktivität von Naturstoffen erkennen, wie Forschende der ETH Zürich gezeigt haben. Darüber hinaus hilft AI, Moleküle zu finden, welche die gleiche Wirkung wie ein Naturstoff haben, aber einfacher in der Herstellung sind. Der Pharmaforschung eröffnen sich damit enorme Möglichkeiten, die auch das Potenzial haben, deren Spielregeln neu zu definieren.
Die Natur hält ein riesiges Reservoir an Heilmitteln bereit. «Über 50 Prozent aller heutigen Medikamente sind von der Natur inspiriert», sagt Gisbert Schneider. Dennoch ist der Professor für Computer-gestützte Medikamentenentwicklung an der ETH Zürich überzeugt, dass bis anhin erst ein kleiner Teil des Potenzials der Naturstoffe genutzt wird. Zusammen mit seinem Team konnte er nun zeigen, wie mit Artificial-Intelligence (AI)-Methoden gezielt neue Arzneianwendungen von Naturstoffen gefunden werden können. Ausserdem lassen sich mit AI-Methoden auch Alternativen zu den Naturstoffen finden, die gleich wirken, aber wesentlich einfacher und damit günstiger in der Herstellung sind.
Zielmoleküle von Naturstoffen
Damit ermöglichen die ETH-Forschenden die Weiterentwicklung der Medizin: Insgesamt verfügen wir heute nämlich erst über rund 4000 grundsätzlich unterschiedliche Arzneistoffe. Diesen stehen je nach Schätzung bis zu 400'000 unterschiedliche menschliche Proteine gegenüber, von denen jedes ein Ziel für ein Medikament sein könnte. Dass sich Schneider bei der Suche nach neuen Arzneistoffen auf die Natur fokussiert, hat gute Gründe. «Die meisten Naturstoffe sind per Definition potenzielle Wirkstoffe, die über evolutionäre Mechanismen ausgewählt wurden», sagt er.
Während Wissenschaftler früher auf der Suche nach neuen Wirkstoffen ganze Naturstoffsammlungen durchforsteten, haben Schneider und sein Team den Spiess nun umgedreht: Sie suchen zunächst mithilfe des Computers nach möglichen Zielmolekülen von Naturstoffen und können auf diese Weise die pharmakologisch relevanten Verbindungen identifizieren. «Die Chancen, auf diesem Weg medizinisch bedeutsame Wirkstoff-Zielprotein-Paare zu finden, sind deutlich grösser als mit dem herkömmlichen Screening», betont Schneider.
Mit bakteriellem Molekül getestet
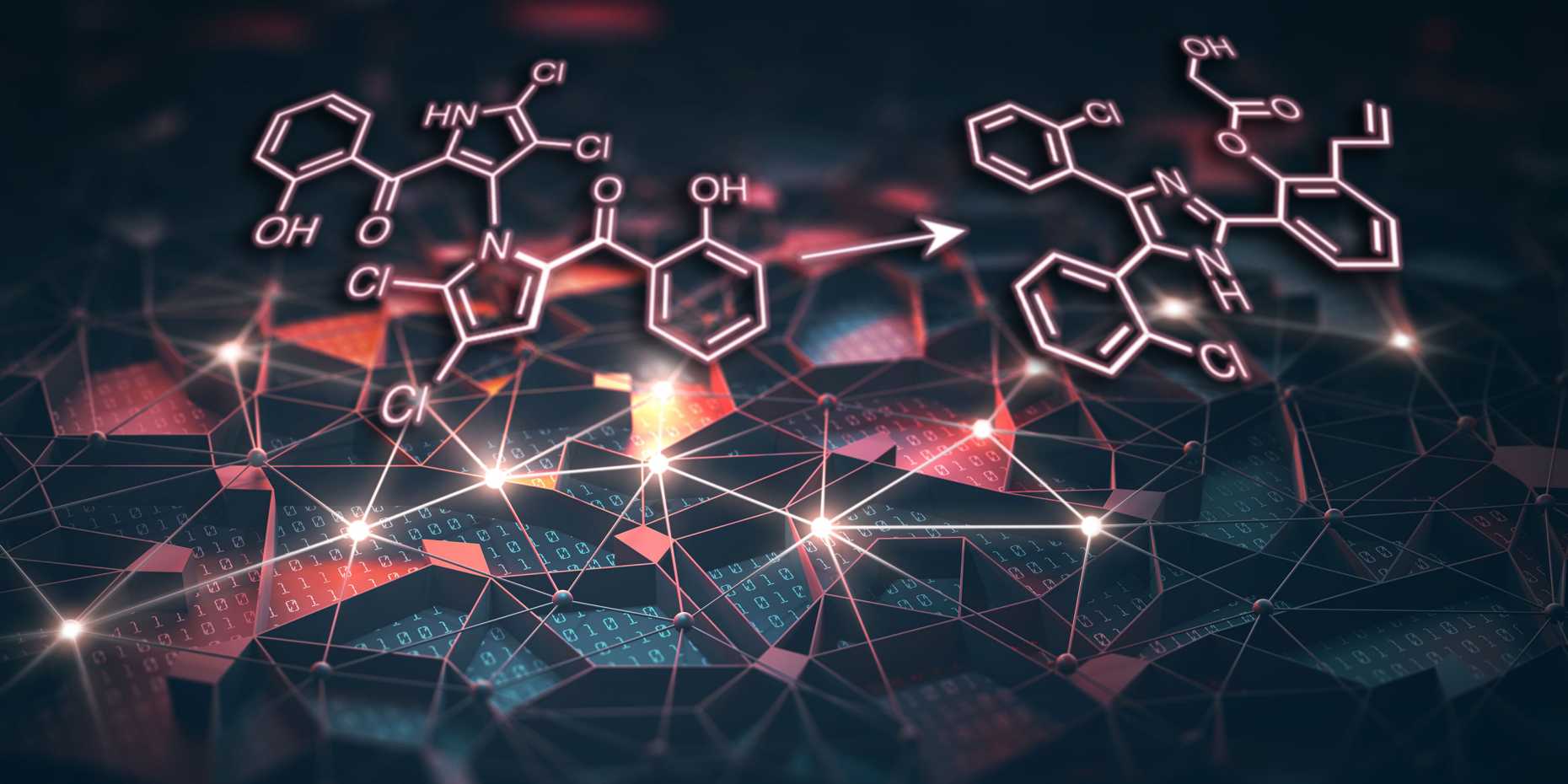
Getestet haben die ETH-Chemiker ihr Konzept mit Marinopyrrol A, einem bakteriellen Molekül, von dem bekannt ist, dass es antibiotisch und entzündungshemmend wirkt sowie anti-Krebs-Eigenschaften aufweist. Mit welchen Proteinen im menschlichen Körper der Naturstoff dabei wechselwirkt, war bis anhin jedoch weitgehend unerforscht.
Um mögliche Zielproteine von Marinopyrrol A zu finden, verwendeten die Forschenden einen von ihnen entwickelten Algorithmus. Dieser verglich mit maschinellen Lern-Modellen die pharmakologisch interessanten Teile von Marinopyrrol A mit den entsprechenden Mustern von Wirkstoffen, von denen bekannt ist, an welche Zielproteine sie sich heften. Anhand der Musterübereinstimmungen konnten die Forschenden acht menschliche Rezeptoren und Enzyme identifizieren, an die sich das bakterielle Molekül heften könnte. Diese sind unter anderem an Entzündungs- und Schmerzprozessen sowie am Immunsystem beteiligt.
Laborexperimente bestätigten, dass Marinopyrrol A tatsächlich mit den meisten der vorhergesagten Proteine messbare Wechselwirkungen eingeht. «Unsere AI-Methode kann die Proteinziele von Naturstoffen mit einer Zuverlässigkeit von oftmals über 50 Prozent eingrenzen und vereinfacht damit die Suche nach neuen Arzneistoffen», hält Schneider fest.
Wirkung gut, günstige Alternative noch besser
Damit war die Arbeit von Schneiders Forschungsgruppe aber noch nicht zu Ende. Wenn aus den Erkenntnissen zu den Wirkungszielen von Marinopyrrol A in Zukunft ein nützliches Medikament entstehen soll, muss auch ein einfach herstellbares Molekül gefunden werden. Marinopyrrol A hat nämlich – wie viele andere Naturstoffe – einen relativ komplizierten Aufbau. Die Laborsynthese ist darum aufwendig und teuer.
Für die Suche nach einer einfacheren, wirkungsgleichen chemischen Verbindung nutzen die ETH-Forschenden einen weiteren von ihnen entwickelten Algorithmus. Die Vorgabe an dieses AI-Programm lautete, dass es als «virtueller Chemiker» Moleküle finden muss, die trotz einer anderen Struktur vergleichbare chemische Funktionalitäten aufweisen wie das Naturvorbild. Gemäss der Vorgabe an de Algorithmus müssen sich zudem die Moleküle in höchstens drei Syntheseschritten und damit vergleichsweise einfach und günstig herstellen lassen.
Neue chemische Strukturen mit gleicher Wirkung
Um den Syntheseweg festzulegen, standen der Software ein Katalog von über 200 Ausgangsstoffen, 25'000 käuflichen chemischen Bausteinen und 58 etablierte Reaktionsschemen zur Verfügung. Nach jedem Reaktionsschritt wählte das Programm als Ausgangsmaterial für den nächsten Schritt jeweils diejenigen Varianten aus, welche die grössten funktionellen Übereinstimmungen mit Marinopyrrol A aufwiesen.
Insgesamt fand der Algorithmus so 802 passende Moleküle, die auf 334 unterschiedlichen Grundstrukturen basierten. Die besten vier stellten die Forschenden im Labor her, und diese zeigten auch tatsächlich eine sehr ähnliche Aktivität wie das Vorbild aus der Natur. Sie wirkten auf sieben der acht durch den Algorithmus identifizierten Zielproteine vergleichbar.
Die Forschenden untersuchten daraufhin das erfolgversprechendste Molekül detailliert. Röntgenstrukturanalysen zeigten, dass sich die berechnete Verbindung ähnlich an das aktive Zentrum eines Zielproteins heftet wie bereits bekannte Hemmstoffe dieses Enzyms. Trotz seines unterschiedlichen Aufbaus hat das durch die AI gefundene Molekül also den gleichen Wirkungsmechanismus.
Auswirkungen auf pharmazeutische Forschung
«Unsere Arbeit belegt, dass sich mit AI-Algorithmen gezielt wirkungsgleiche, aber einfacher aufgebaute Wirkstoffe entwerfen lassen», bilanziert ETH-Professor Schneider. «Dies hilft auf der einen Seite, neue Medikamente zu entwickeln. Auf der anderen Seite stehen wir damit aber auch am Anfang eines möglicherweise fundamentalen Wandels in der medizinisch-chemischen Forschung.» Mit den AI-Methoden der ETH-Forschungsgruppe lassen sich nämlich genauso wirkungsgleiche, aber auf unterschiedlichen Strukturen beruhende Alternativen zu bestehenden Medikamenten finden.
Dadurch könnte es in Zukunft leichter werden, neue patentfreie Molekülstrukturen zu entwerfen. Die Frage, inwieweit AI zur systematischen Umgehung eines Patentschutzes verwendet werden könnte, wird aktuell genauso intensiv diskutiert, wie eine mögliche Patentierung von Molekülen, die eine «kreative» AI entworfen hat. Die Pharmaindustrie wird ihren Forschungsansatz an die neuen Spielregeln anpassen müssen.
Literaturhinweis
Friedrich L et al.: Learning from Nature: From a Marine Natural Product to Synthetic Cyclooxygenase-1 Inhibitors by Automated De Novo Design. Advanced Science, 27. Juni 2021, doi: externe Seite 10.1002/advs.202100832
Kommentare
Noch keine Kommentare